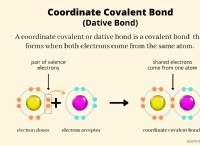
H2 (g) + S (S) → H2S (g) ΔHF =-20.6 kJ/mol
고장은 다음과 같습니다.
* H2 (g) : 표준 상태의 수소 가스 (규정 분자)
* s (s) : 표준 상태의 고체 황 (마름모꼴 황)
* H2S (g) : 황화수소 가스, 화합물이 형성되고있다
* ΔHF =-20.6 kJ/mol : 이는 반응이 형성된 H2의 두더지 당 20.6 kJ 열을 방출하여 발열 반응임을 나타냅니다.
키 포인트 :
* 형성 엔탈피는 항상 하나의 제품에 대해 정의됩니다.
* 요소는 298k (25 ° C) 및 1 ATM 압력의 표준 상태에 있어야합니다.
* 음성 ΔHF는 발열 반응을 나타냅니다 (열이 방출됨).
* 양성 ΔHF는 흡열 반응을 나타냅니다 (열이 흡수됨).