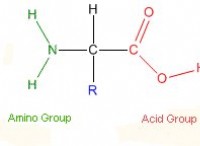
설명 :
* 이온 크기 및 전하 밀도 : 브로마이드 이온 (Br-)은 클로라이드 이온 (Cl-)보다 큽니다. 이 더 큰 크기는 전하 밀도를 낮추어 주변 물 분자와의 상호 작용이 약해집니다.
* 분극성 : 브로마이드 이온은 클로라이드 이온보다 편광 가능합니다. 분극성은 이온의 전자 구름이 왜곡 될 수있는 용이성을 나타냅니다. 분극성이 커지면 물 분자와의 더 강한 상호 작용을 유발하여 용해도가 향상됩니다.
* 수화 에너지 : 브로마이드 이온의 수화 에너지는 일반적으로 클로라이드 이온의 수화 에너지보다 높다. 수화 에너지는 이온이 물에 용해되어 물 분자와 상호 작용할 때 방출 된 에너지를 나타냅니다. 더 높은 수화 에너지는 용해도를 선호합니다.
따라서, 브로마이드 염은 크기가 더 크기 때문에 모든 온도에서 클로라이드 염보다 더 가용성이있는 경향이 있습니다.
참고 : 이것은 일반적인 추세이며 관련된 특정 양이온에 따라 구체적인 예외가있을 수 있습니다.