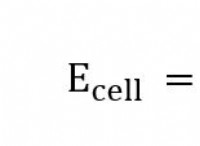균형 화학 방정식
마그네슘 (Mg)과 산소 (O₂) 사이의 반응은 산화 마그네슘 (MGO)을 생성합니다.
2 mg + o₂ → 2 mgo
설명
* 반응물 :
* 마그네슘 (MG) :은빛 흰색 금속.
* 산소 (O () :우리가 호흡하는 공기의 많은 부분을 구성하는 무색 가스.
* 제품 :
* 산화 마그네슘 (MGO) :의학 및 구조에 일반적으로 사용되는 흰색 분말.
* 화학량 측정법 :
* 방정식은 균형을 이루므로 각 요소의 원자 수는 양쪽에서 동일합니다. 이것은 반응이 질량 보존 법칙을 따른다.
* 각 분자 앞에있는 계수는 반응에 관여하는 두더지의 비율을 알려줍니다. 방정식은 다음을 보여줍니다.
* 2 몰의 마그네슘 (mg)은 1 몰의 산소 (O₂)와 반응하여 2 몰의 산화 마그네슘 (MGO)을 생성합니다.
2 몰의 산화 마그네슘 형태
1. 마그네슘 (mg)은 산소 (O₂) :와 반응합니다 마그네슘 금속이 산소 가스와 접촉하면 화학 반응이 발생합니다.
2. 마그네슘 원자는 전자를 잃습니다 (산화) : 각 마그네슘 원자는 마그네슘 이온 (mg²⁺)이되기 위해 2 개의 전자를 잃게됩니다.
3. 산소 원자는 전자를 얻습니다 (환원) : 산소 분자의 각 산소 원자는 산화물 이온이되기 위해 2 개의 전자를 얻습니다 (O²⁻).
4. 산화 마그네슘 형성 (MGO) : 양전하 하전 된 마그네슘 이온 (mg²⁺) 및 음으로 하전 된 산화물 이온 (O²⁻)은 서로를 끌어 들이고 이온 성 화합물, 산화 마그네슘 (MGO)을 형성합니다.
중요한 참고 : 이 반응은 매우 발열이므로 많은 열과 빛을 방출합니다. 실험실 에서이 반응을 관찰하려면 마그네슘이 밝게 타는 것을 볼 수 있습니다!