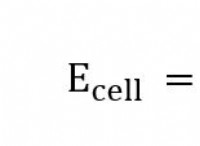1. 산과 염기의 강도 :
* 강한 산 + 강한 염기 : 이 조합은 * 중립 솔루션을 생성합니다. 강산 및 염기는 물에서 완전히 이온화되므로 양성자 (H+)를 완전히 기부하거나 수용합니다. 동일한 양이 반응하면 H+ 및 OHION이 서로를 중화시켜 물과 소금 만 남습니다.
* 약산 + 약한 염기 : 이 조합은 일반적으로 중립이 아닌 솔루션을 초래합니다. 약산 및 염기는 부분적으로 이온화되므로 과량의 H+ 또는 오하이온이있을 수있어 약간 산성 또는 기본 용액이 발생할 수 있습니다.
* 강한 산 + 약한 염기 : 이 반응은 산성 용액을 생성 할 것이다. 강산은 약한 염기가 중화 될 수있는 것보다 더 많은 H+ 이온을 기증합니다.
* 약산 + 강한 염기 : 이 반응은 기본 솔루션을 생성 할 것입니다. 강력한베이스는 약산이 중화 될 수있는 것보다 더 많은 옴을 기증 할 것입니다.
2. 화학어 측정법 :
* 동일하지 않음 : 산과 염기가 강하더라도 1 :1 몰비로 존재하지 않으면 용액이 중립적이지 않습니다. 과도한 반응물은 pH를 결정할 것이다.
예 :
1 몰의 HCL (강산)을 1 몰의 NaOH (강한 염기)와 반응한다고 가정 해 봅시다.
* HCL + NAOH → NACL + H2O
반응은 1 몰의 NaCl (염) 및 1 몰의 H2O (물)를 생성하여 중성 용액을 생성합니다.
요약 :
동일한 양의 산과 염기가 항상 중립 용액을 생성한다는 진술은 지나치게 단순화됩니다. 그것은 1 :1 몰비로 반응하는 강산과 염기에만 해당됩니다. 생성 용액의 실제 pH는 산 및 염기의 강도 및 상대적 양에 따라 다릅니다.