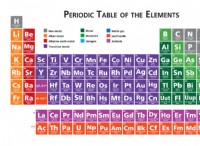
그룹 1 및 2 요소 (S- 블록 요소) :
* 전자 구성 : 그들의 원자가 전자는 * s * 궤도에서만 발견됩니다.
* 그룹 1 (알칼리 금속) :NS¹
* 그룹 2 (알칼리성 지구 금속) :NS²
* 반응성 : 그들은 안정적인 고귀한 가스 구성을 달성하기 위해 원자가 전자를 쉽게 잃어 버려서 반응성이 높습니다.
전이 금속 (D- 블록 요소) :
* 전자 구성 : 그들의 원자가 전자는 * s * 및 * d * 궤도 모두에서 발견됩니다.
* 일반 구성 :(N-1) D¹-¹⁰ NS¹-²
* 가변 산화 상태 : D 궤도는 결합에 참여하여 전이 금속이 다수의 산화 상태를 가질 수있게한다. 이것은 다양한 화학 및 화려한 화합물의 형성에 기여합니다.
* 반응성이 적습니다 : 전이 금속은 원자가 전자를 강하게 유지하기 때문에 그룹 1 및 2 요소보다 일반적으로 반응성이 떨어집니다.
* 파라 마그네시즘 : d 궤도에 짝을 이루지 않은 전자의 존재는 많은 전이 금속이 상자성을 만들어 자기장에 끌린다.
주요 차이점 :
* 궤도 충전 : 전이 금속은 D 궤도를 채우고 그룹 1 및 2 요소는 S 궤도 만 채 웁니다.
* 반응성 : 전이 금속은 그룹 1 및 2 요소보다 반응성이 떨어집니다.
* 가변 산화 상태 : 전이 금속은 결합에 대한 D 궤도 참여로 인해 가변 산화 상태를 가지며, 그룹 1 및 2 요소는 고정 된 산화 상태 (각각 +1 및 +2)를 갖는다.
예 :
* 나트륨 (그룹 1) : 1S² 2S² 2P⁶ 3S¹ (안정적인 구성을 달성하기 위해 1 개의 전자 손실)
* 철 (전이 금속) : 1S² 2S² 2P⁶ 3S² 3S² 4S² 3D (이온을 형성하기 위해 2, 3 또는 더 많은 전자를 잃을 수 있음)
요약 : 전이 금속의 전자 구성에 d 궤도의 관여는 가변 산화 상태, 다양한 화학 및 상용기와 같은 고유 한 특성으로 이어져 그룹 1 및 2의 S- 블록 요소와 구별됩니다.