핵심 개념
이 튜토리얼에서는 용해도 의 속성을 소개합니다. 그리고 그것을 영향을 미치는 다양한 요인. 또한 용질, 용매 및 솔루션을 소개합니다.
다른 기사에서 다루는 주제
- KSP- 용해도 제품 상수
- 극성 공유 결합이란 무엇입니까
- 분자간 힘
- 평형 상수는 무엇입니까
- 솔벤트
어휘
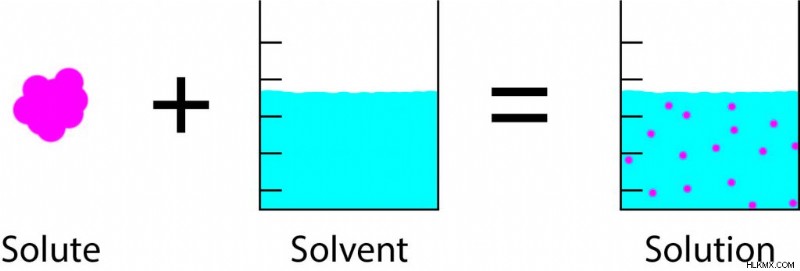
- 용질 - 용매에 용해되어 균질 혼합물을 형성하는 물질입니다.
- 용매 - 용질을 용해시키는 데 사용되는 물질입니다. 이것은 일반적으로 더 많은 양의 물질입니다.
- 솔루션 - 하나 이상의 용질의 균질 한 혼합물.
솔루션 이해
용해도를 먼저 이해하려면 솔루션을 구성하는 것이 무엇인지 이해해야합니다. 용액은 용질 및 용매로 구성됩니다. 이 둘의 차이점을 이해하려면 바닷물의 예를 참조하십시오. 물은 용매 입니다 그것은 용질을 용해시키는 데 사용되는 물질이기 때문입니다. 소금은 용질 입니다 물이 물에 용해되는 물질이기 때문입니다. 용매는 일반적으로 용액에서 더 풍부합니다. 솔루션은 세 가지 물질 상태의 모든 형태로 나올 수 있습니다. 즉, 모든 솔루션이 액체가 아니라 강철은 해결책입니다.
솔루션으로 간주 되려면 다른 성분 (용질 및 용매)의 비율을 고려해야합니다. 한 컵 아래의 사진에는 설탕이, 다른 하나는 소금으로, 마지막에는 진흙으로 가득 차 있습니다. 진흙으로 가득 찬 컵은 소금과 설탕을 곁들인 컵과 매우 구별됩니다. 진흙으로 채워진 컵은 이질적인 혼합물이며 용액이 아니기 때문입니다. 모든 솔루션은 균질하므로 구성이 전체적으로 균일하다는 것을 의미합니다.
.

용해도
용해도는 용액에 용해되어 용액을 형성하는 용질의 능력이다. 이것은 설탕 분자와 같은 물건이 커피 한 잔에 녹일 수있는 속성입니다. 물은 대부분의 물질을 녹일 수 있지만 몇 가지 예외가 있기 때문에 "보편적 인 용매"로 알려져 있습니다.
용해도는 용질 분자와 용매 분자 사이에 새로운 결합을 형성합니다. 이것은 주어진 온도에서 알려진 용매 농도에 용해되는 용질의 최대 농도입니다. 용질은 세 가지 범주로 분류됩니다. 가용성으로 간주되기 위해서는 0.1g 이상의 용질 농도가 100ml 용매에 용해 될 수있다. 0.1 g 미만의 농도가 용매에 용해된다면 그것은 드물게 가용성이라고합니다. 용해도는 1 리터의 포화 용액에서 용질 그램의 수를 표현할 수 있습니다. 예를 들어, 물의 용해도는 25 ℃에서 12 g/L로 표시 될 수있다. 몰 용해도는 포화 용액의 1 리터 당 용질의 두더지의 수이다. 예를 들어, 25 c에서 0.115 mol/L
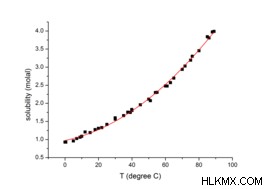
용해도에 영향을 미치는 요인
온도
용질 용해도에 영향을 줄 수있는 요인 중 하나는 온도의 변화입니다. 온도가 변경되면 물질의 용해도를 높일 수 있습니다. 드물게 고체-액체는 온도를 증가시킴으로써 완전히 용해 될 수있다. 예를 들어, 설탕은 더 높은 온도에서 물에 더 용해 될 수 있습니다. 기체 상태 온도에서 물질의 경우 역 효과가 있습니다. 따라서 온도가 증가함에 따라 액체에서 가스의 용해도가 감소합니다.
채권 및 다양한 힘
힘과 결합은 또한 물질 용해도에 영향을 줄 수 있습니다. 결합 및 분자간 힘의 유형은 각 물질과 분자마다 다릅니다. "용해처럼"라는 용어는 극성 용질을 용해시키는 극성 용매 및 비극성 용질을 용해시키는 비극성 용매를 설명하는 데 사용될 수 있습니다. 예를 들어, 물은 극성 용매이기 때문에 극성 분자이기 때문에 염산을 용해시키는 데 사용될 수 있습니다. 따라서, 용질 분자와 용매 분자 사이의 분자간 력이 더 강할수록 용매에서 용질의 용해도가 더 크다.
.압력
압력은 다양한 방식으로 용해도에 영향을 줄 수 있습니다. 압력에 관해서는 가스가 액체보다 훨씬 더 많은 영향을받습니다. 압력과 용해도는 직접 관련이 있으므로 부분 압력이 증가 할 때 용해도도 증가합니다. 압력이 감소하면 용해도에 대해서도 동일하게 발생합니다. 예를 들어, 실온에서의 물은 이미 가스 분자를 용해시켰다. 물이 끓을 때 가스가 거품 형태로 빠져 나와 가스의 용해도가 감소합니다.
액체에서 고체의 용해도
고체의 용해도는 용질 및 용매의 인자에 의존하는 것으로 추론 될 수있다. 물질의 다양한 분자간 힘으로 인해, 극성 용질만이 극 용매에 용해되는 경향이 있고 비극성 용매 만 용해되는 경향이 있음을 알았습니다.
고체 용질을 용매에 넣은 후, 용질의 입자는 용매에 용해된다. 이 시점에서 동적 평형에 도달합니다. 용액의 용질 분자의 수는 용액에서 플러시되는 입자의 수와 같습니다. 용액에서 용질의 농도는 주어진 온도 및 압력에서 일정하게 유지 될 것이다. 더 이상 용질이 용매에 용해 될 수없는 경우 용액은 포화 된 것으로 간주됩니다. 이것은 몰토리성 (m)과 용해도가 직접 관련이있을 때입니다. 용질의 몰비는 용해도와 같습니다. 이러한 용액에서 용질의 농도를 주어진 온도 및 압력에서 용해도라고합니다. 용액에 더 이상 용질을 첨가하지 않으면 용액이 불포화됩니다.