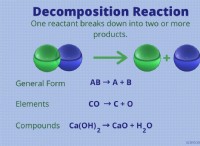
우리가 원자 (또는 분자) 수준에서 입자에 대해 이야기하고 있다면 순수한 원소의 한 곡물조차도 상당수의 원자를 가지고있는 것으로 잘 알려져 있습니다. 이것은 두더지 개념의 가장 일반적인 응용 중 하나입니다. 특히, 그것은 매우 많은 입자의 총 입자 수를 나타내는 '몰'으로 알려진 단위에 집중합니다.
두더지
6.02214076 * 1023 제공된 재료의 '기본 엔티티'는 화학 분야의 두더지로 정의되며, 두더지는 주어진 물질의 정확히 6.02214076 * 1023 '기본 엔티티'를 포함하는 물질의 양으로 정의됩니다.
.수학에서, 6.02214076*1023은 아보 가드로 상수라고하며, 징후 Na에 의해 자주 상징됩니다. '원자, 분자, 모나상/다 원소 이온 및 몰에서 표현할 수있는 다른 기본 실체는 아톰, 분자 및 기타 기본 사물을 포함합니다 ( 탄소 -12 (12c)를 예로 들어, 순수한 카본 -12 (12c)의 1 몰은 12 개의 그래머의 정확한 질량을 가지며 12c의 6.02214076*1023 (NA) 원자를 함유 할 것이다. 이 공식은 해당 물질의 주어진 순수한 샘플에 존재하는 물질의 몰의 수를 나타내는 데 사용될 수 있습니다.
n =n/na는 문자 n이 문장에 나타나는 횟수입니다.
Avogadro의 상수는 다음과 같이 정의됩니다. n =재료 (또는 기본 엔티티), n =샘플의 기본 엔티티 수, na =avogadro 상수.
로 정의됩니다.Mole은 1896 년 독일 화학자 Wilhelm Ostwald가 처음으로 사용한 용어로, 라틴어 Moles에서 용어를 도출했으며 문자 그대로 '힙'또는 '더미'로 번역됩니다.
.두더지의 두더지 개념의 개념
분자의 두더지의 수가 반드시 분자 자체를 구성하는 원소의 몰의 수와 같을 필요는 없다. 예를 들어, 두더지의 물은 0이 아닌 양의 수소 원자를 포함합니다. 한편, 각각의 물 분자는 2 개의 수소 원자와 하나의 산소 원자를 포함한다. 결과적으로, 1 몰의 H2O는 동일한 비율로 2 몰의 수소와 1 몰의 산소를 함유합니다.
두더지 아이디어와 관련된 양과 공식 원자 및 분자 질량은 두 가지 다른 것입니다.
요소의 원자 질량에 대해 이야기 할 때, 우리는 원자 질량 단위 (AMU)에 표시된 해당 요소의 원자의 질량에 대해 이야기하고 있습니다. 그것은 당신이 요소의 다양한 동위 원소의 풍부함을 설명하고 요소의 하나의 원자의 질량에 가중 평균 값을 할당 할 수 있습니다.
.국제 원자 질량 단위 시스템에 따르면, 탄소 샘플은 일반적으로 탄소 -12 동위 원소의 98.89 %, 탄소 -13 동위 원소의 1.11 % 및 탄소 -14의 미량량을 포함하기 때문에 탄소의 원자 질량은 12.011 원자 질량 단위이다. 반면 에이 동위 원소의 원자 질량은 다릅니다.
Carbon-12와 비교하여, Carbon-13은 13 개의 원자 질량 단위 (AMU)의 원자 질량을 가지며, 이는 Carbon-12의 경우 12 amu보다 큽니다. 요소와 관련하여 특정 요소의 원자 질량은 요소의 핵에 존재하는 모든 양성자 및 중성자의 합과 거의 동일합니다.
원소의 분자 질량은 해당 요소를 구성하는 모든 요소의 원자 질량의 총계와 같습니다. 원자 질량 단위 로이 양을 표현하는 것도 가능합니다. 따라서, 물의 분자 질량은 수소와 산소의 구성 요소의 원자 질량의 총과 같으며 물의 분자량이라고 불린다.
수소의 원자 질량은 1.00794 AMU를 가지며, 산소는 원자 질량이 15.9994 AMU입니다. 물 분자는 2 개의 수소 원자와 하나의 산소 원자를 함유하기 때문에 H2O의 분자 질량은 18.0154 AMU이며, 이는 물의 분자 질량과 동일합니다.
물질의 몰 질량은 (그램의 물질의 질량)과 동일합니다.
물의 몰 질량은 대략 18.015 g/mol이며, 이는 1 백 15 개의 물 분자 (NA 번호)의 질량에 해당합니다.
그램 원자 질량과 그램 분자 질량은 두 가지 다른 양입니다.
원소 원자 질량의 그램은 그램에서 해당 요소의 1 몰의 질량과 같습니다. 이와 유사하게, 화학 물질의 문법 분자 질량은 그 화합물의 단일 두더지의 질량이다. 결과적으로, 수소의 문법 원자 질량은 대략 1.007g이고, 물의 문법 분자 질량은 수소의 문법 당 약 18.015g입니다.
결론
어금니 질량은 어금니 질량의 물질의 양을 설명하는 데 사용되는 용어입니다.
일반적으로, 물질의 몰 질량은 물질의 한 몰에 함유 된 총 질량으로 정의된다. 그것은 종종 다수의 '두더지 당 문법'(g/mol) 단위로 표현됩니다. 반면 에이 수량의 SI 장치는 두더지 당 킬로그램입니다. 다음 공식을 사용하여 어금니 질량을 나타내는 것이 가능합니다.