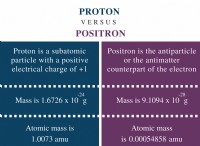
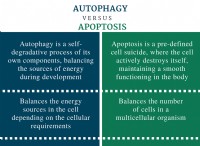
혼성화 정의
화학에서, 혼성화는 2 개의 원자 궤도를 결합하여 새로운 유형의 하이브리드 화 된 궤도를 생성하는 과정으로 정의된다. 완전히 다른 에너지, 모양 등을 갖는 하이브리드 궤도의 형성은 종종이 혼합의 결과입니다. 혼성화는 대부분 동일한 에너지 수준의 원자 궤도에 의해 수행됩니다. 그러나 완전히 채워지고 반으로 가득 찬 궤도는 에너지가 동등하다면이 과정에 참여할 수 있습니다.
혼성화 란 무엇입니까?
혼성화는 원자 궤도가 결합되어 새로 하이브리드 화 된 궤도를 형성하여 분자 형상 및 결합 특성에 영향을 미칠 것이라는 생각이다. 우리는 혼성화가 또한 원자가 결합 이론의 확장이라고 말할 수 있습니다. 이 아이디어를 더 탐구하기 위해 우리는 SP3, SP2 및 SP 혼성화를 설명하기 위해 세 가지 유형의 탄화수소 화합물을 활용할 것입니다.
혼성화의 특성
하이브리드 화의 다음 특성 중 일부는 다음과 같습니다. :
1. hybridization은 동일한 원자 또는 이온에 속하는 궤도가 유사한 에너지를 가질 때 발생합니다.
2. 하이브리드 궤도의 수는 하이브리드 화 과정에 관련된 궤도의 수와 같습니다.
3. 에너지와 모양의 용어로, 하이브리드 궤도는 항상 비슷합니다.
4. 순수한 원자 궤도와 비교하여 하이브리드 궤도는 더 안정적인 결합을 생성합니다.
5. 하이브리드 화의 목표는 가장 대칭을 가진 동등한 궤도를 만드는 것입니다.
6. 혼성화가 실제로 발생하는지 여부는 알 수 없습니다. 현실 세계에서 분자가 어떻게 행동하는지 설명하는 이론입니다.
7. 하이브리드 궤도는 안정적인 배열을 갖고 분자에 적절한 형태를 제공하기 위해 동일한 원하는 방향으로 공간에 지시됩니다.
유형의 하이브리드 화
혼성화 유형
혼성화 유형은 다음과 같습니다.
1) (SP) 하이브리드 화
SP 하이브리드 화에서 하나의 S- 및 1 개의 p- 궤도를 결합하여 선형 구조와 180 도의 결합 각인을 갖는 2 개의 SP- 하이브리드 궤도를 생성한다.
각 SP 하이브리드 궤도는 S 및 P 문자의 비율과 같은 비율 - 50 % S 문자 및 50 % P 문자를 가지고 있습니다.
예를 들어, BECL2가 형성 될 때, 첫 번째 원자는 여기 상태 2S12P1에있는 다음, 두 개의 SP - 하이브리드 궤도를 생성하도록 혼성화된다. Becl2is는 이들 하이브리드 궤도가 2 개의 염소 원자의 2 개의 p- 궤도와 충돌 할 때 형성됩니다.
2) (sp 2) 하이브리드 화
하나의 S- 및 1 개의 p- 궤도는 3 개의 SP2- 하이브리드 궤도를 삼각 평면 모양과 120 도의 결합 각으로 생성합니다.이 3 개의 하이브리드 궤도는 동일한 평면에 남아 있으며 서로 120 ° 각도를 형성합니다. 하이브리드 궤도는 각각 33.3 %의 '' '캐릭터와 66.66 %'P '문자를 가지고 있습니다.
삼각형 평면 형태는 중앙 원자가 3 개의 다른 원자에 연결되고 SP2 하이브리드 화 된 모든 분자에서 발견됩니다.
3) (sp 3) 하이브리드 화
이 하이브리드 화에 하나의 S- 및 3 개의 p- 궤도가 병합되어 사면체 구조를 가진 4 개의 SP3- 하이브리드 궤도를 생성합니다. 이들은 기존의 사면체의 4 개의 모서리를 목표로하며 서로 109 ° 28 ′ 각도를 형성합니다.
.SP3 하이브리드 궤도는 그들 사이에 109.280도 각도를 갖습니다.
각 SP3 하이브리드 궤도에는 25% S 문자와 75% P 특성이 포함됩니다.
에탄과 메탄은 SP3 혼성화의 두 가지 예입니다.
4) (sp 3d) 하이브리드 화
동일한 에너지의 5 개의 SP3D 하이브리드 화 궤도를 생성하기 위해 1S, 3P 및 1D 궤도의 중간 혼합을 SP3D 하이브리드 화로 알려져 있습니다. 그들의 기하학은 삼각형 bipyramidal입니다.
삼각형 이피라미드 대칭은 s, p 및 d orbitals를 결합하여 형성됩니다.
적도 궤도는 수평 평면의 3 개의 하이브리드 궤도이며, 서로 120 ° 각도로 기울어 진 수평 평면입니다.
축 방향 궤도로 알려진 나머지 2 개의 궤도는 적도 궤도에서 90 도의 수직 평면에 있습니다.
인 펜타 클로라이드의 혼성화 (PCL5).
5) sp 3D2 하이브리드 화
SP3D 하이브리드 화의 1S, 3P 및 2D 궤도는 6 개의 동일한 SP3D2 하이브리드 궤도를 생성하도록 혼합된다.
이 6 개의 궤도는 팔면체의 모서리를 목표로합니다.
그들은 서로 90도 각도로 각도를 유지합니다.
결론
혼성화는 원자-원자 결합뿐만 아니라 분자 형태를 설명합니다. 혼성화는 동일한 에너지 수준의 2 개 이상의 분리 된 순수 원자 궤도를 혼합 (혼성화)하여 둘 이상의 동일한 하이브리드 원자 궤도를 생성하는 과정입니다.
혼성화는 강력한 진화력으로 간주됩니다.
(1) 참여하는 집단들 사이에서 특이 적 유전 적 다양성 증가
(2) 새로운 종의 출현
(3) 유전 적 동화로 인한 종의 멸종