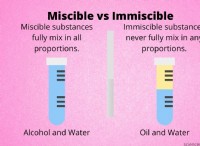
결합 해리 엔탈피를 균질 핵분열을 통해 절단 될 때 발생하는 엔탈피의 표준 변화로서 본드 해리 엔탈피를 정의 할 수 있습니다. 결합의 동종 분해의 결과로 형성된 라디칼이 가장 일반적입니다.
본드 해리 엔탈피
두 종들 사이의 화학적 결합의 결합 해리 엔탈피는 두 종 사이의 화학적 결합의 강도를 추정하는데 사용될 수있다. 그것은 종종 절대 제로에서 화학 결합의 균질 핵분열의 엔탈피 변화로 정의되지만, 일반적으로 표준 조건 (298k) (0k)에서 엔탈피 변화로 측정됩니다.
.본드 해리 엔탈피의 특징
두 가지 다른 종의 유기체 사이에 존재하는 화학적 결합을 깨기 위해 공급 해야하는 에너지의 양입니다.
이 방법을 사용하여 화학적 결합 강도를 계산할 수 있습니다.
특히 규정 분자와 관련하여, 그것은 결합 에너지의 가치와 같습니다.
실리콘과 불소 사이의 결합은 알려진 모든 화학 결합의 가장 높은 결합 해리 엔탈피를 가지고 있다고합니다.
원자 또는 분자 사이의 공유 결합은 정전기 인력에 의해 형성되기 때문에 낮은 결합 해리 에너지를 갖는 것으로 알려져 있습니다.
이원성 분자의 경우, 이전에 논의 된 바와 같이, 본드 해리 엔탈피는 결합 에너지와 동일하며, 이는 결합 에너지가 보존됨을 의미한다. 이는 결합 에너지가 분자에서 동일한 유형의 모든 결합의 모든 결합 분리 엔탈피의 평균 값이기 때문이며, 본드 에너지는 다음과 같이 계산됩니다.
.예를 들어, 변형을 완료하기 위해 모든 수소 원자를 제거 해야하는 메탄 분자를 고려하십시오. 제 1 수소 분자를 제거하는 데 필요한 에너지는 105 kcal/mol 인 반면, 제 2 수소 분자를 제거하는 데 필요한 에너지는 110 kcal/mol입니다. 이들 하이드로겐에 대해 세 번째 및 제 4 수소의 결합 해리 엔탈피는 각각 101 kcal/mol 및 81 kcal/mol 인 것으로 계산된다. 이들 값을 평균함으로써, 총 결합 에너지는 99 kcal/mol이며, 이는 앞에서 언급 한 바와 같이 C-H 결합의 결합 해리 에너지와 같지 않다는 것이 밝혀졌다.
.본드 엔탈피와 본드 해리 엔탈피의 차이
본드 엔탈피와 본드 해리 엔탈피 사이에는 상당한 차이가 있음에 주목해야합니다.
규조토 분자를 제외하고, 결합-소포 엔탈피는 결합 엔탈피에 대립 적으로 반대한다. 주어진 분자의 경우, 결합-소포 엔탈피는 하나의 단일 화학 결합을 분리하는데 필요한 에너지를 나타내는 반면, 결합 엔탈피는 해당 분자에 대해 유사한 유형의 결합의 모든 결합-소포 엔탈피의 평균을 나타낸다. 동종성 화합물 EXN의 경우, 응답 EXN → E + NX의 엔탈피 변화는 E -X 결합의 엔탈피 변화를 (1/N)의 계수 만 증가시킨다. 결과적으로, 본드 엔탈피는 평균 결합 분리 엔탈피라고도 할 수 있으며, 본드 해리 엔탈피는 분리의 표준 엔탈피라고 할 수 있으며, 본드 엔탈피는 또한 해리의 표준 엔탈피라고도한다.
.달리 명시되지 않는 한, 표에 주어진 평균 결합 엔탈피는 고려중인 채권의 "일반적인"결합 사례를 포함하는 다양한 종 범주의 결합 엔탈피의 정상 추정이다. 예를 들어, 물 분자 (H2O)에서 HOH 결합을 깨뜨리려면 118.8 kcal/mol (497.1 kJ/mol)의 에너지가 필요합니다. 나머지 하이드 록실의 분리는 101.8 kcal/mol (425.9 kJ/mol)의 에너지를 필요로한다. 기존의 지혜에 따르면, 물에서 O-H 공유 결합의 엔탈피는 110.3 kcal/mol (461.5 kj/mol)이며, 이는 본질적으로 이러한 값의 평균입니다.
메탄으로부터의 진행성 수소 원자를 제거하기 위해, 결합-소포 성 엔탈피는 다음과 같다 :D (CH3-H) :110 kcal/mol (460 kJ/mol), d (CH2-H) :101 kcal/mol (423 kJ/mol) 및 d (CH-H) :81 kcal/mol (339 kj/mol) 계산 된 결합 유제. 이러한 방식으로 414 kJ/mol (결합-소포 엔탈피의 정상). 개별 결합-소포 엔탈피 중 어느 것도 99 kcal/mol의 결합 에너지에 접근하지 않으며, 이는 가능한 최대입니다.
가장 약하고 가장 강한 강점을 가진 화학적 결합
결합 해리 엔탈피의 개념은 가장 약하고 가장 강한 화학 결합을 식별하는 데 사용될 수 있습니다. 앞서 논의한 바와 같이, 실리콘과 불소 사이의 결합은 지금까지 발견 된 가장 강력한 화학적 결합 인 것으로 밝혀졌다.
실리콘 테트라 플루오 라이드 분자에서, 제 1 실리콘-플루오린 결합을 파괴하는 데 필요한 결합 분리 에너지는 166 kcal/mol 또는 166 kcal/mol 인 것으로 추정된다. 실리콘과 불소 원자 사이의 전기 성분의 큰 차이와 불소 전체가주기적인 표에서 가장 전기 음성 요소라는 사실로 인해 설명 할 수 있습니다.
중성 화합물로 이동하여, 일산화탄소의 탄소-산소 결합은 257 kcal/mol의 결합 분리 에너지와 함께 알려진 결합의 가장 높은 강도를 갖는 것으로 밝혀졌다. Ethyne의 탄소-탄소 결합은 비교적 높은 결합 분리 에너지를 가지고 있으며, 이는 약 160 kcal/mol.
로 추정됩니다.결과적으로, 본드 해리 엔탈피의 개념은 앞에서 언급 한 바와 같이 열 화학 분야에서 매우 유용한 것으로 밝혀졌다.
.결론
결합 해리 엔탈피를 균질 핵분열을 통해 절단 될 때 발생하는 엔탈피의 표준 변화로서 본드 해리 엔탈피를 정의 할 수 있습니다. 결합의 동종 분해의 결과로 형성된 라디칼은 가장 흔합니다. 두 종 사이의 화학적 결합의 결합 해리 엔탈피는 두 종 사이의 화학 결합의 강도를 추정하는 데 사용될 수 있습니다. 그것은 종종 절대 제로에서 화학적 결합의 균질 핵분열의 엔탈피 변화로 정의됩니다. 그것은 두 가지 다른 유기체 사이에 존재하는 화학적 결합을 깨기 위해 공급 해야하는 에너지의 양입니다.