주요 차이 - Henry 's Law vs Raoult's Law
Henry의 법과 Raoult의 법칙은 열역학에서 발견 된 두 가지 법칙이며 서로 평형 상태에있는 솔루션과 그 증기 사이의 관계를 설명합니다. Henry의 법칙은 물과 같은 액체 용매에 가스의 용해를 설명하는 데 사용될 수 있습니다. Raoult의 법칙은 증기 압력과 평형 상태에있는 용액에서 용매의 거동을 나타냅니다. 그러나 실제 솔루션에 이러한 법률을 적용 할 때 특정 제한 사항이 있습니다. Henry의 법과 Raoult의 법의 주요 차이점은 H Enry의 법칙이 솔루션의 용질의 행동을 설명하는 반면 Raoult의 법칙은 솔루션에서 용매의 행동을 설명한다는 것입니다.
주요 영역을 다루었습니다
1. Henry의 법칙은 무엇입니까
- 예, 한계가있는 법률의 설명
2. Raoult의 법칙은 무엇입니까
- 예, 한계가있는 법률의 설명
3. Henry의 법과 Raoult의 법의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :Henry 's Law, Raoult's Law, Solute, Solution, Solvent 
Henry의 법칙은 무엇입니까
Henry의 법칙은 액체 매체에 가스의 용해를 설명하는 가스 법입니다. 이 법은 액체에 용해 된 가스의 양은 액체와 평형을 이루는 가스의 부분 압력에 직접 비례한다고 말합니다. 이것은 다음과 같이 방정식으로 제공 될 수 있습니다.
[a (aq) ] =k h .p a (g)
여기서, [a (aq) ] 용액에 용해 된 가스 A의 농도
k h 헨리의 법률 상수입니다
p a (g) (g) 의 부분 압력입니다
헨리의 법률 상수는 비례 상수이며 용매, 용질 및 온도의 유형에 따라 다릅니다. 따라서 특정 가스의 경우 Henry의 법률 상수는 온도에 따라 다를 수 있습니다. 따라서 물에서 가스의 용해도를 계산할 때 특정 온도에서 Henry의 법칙 상수의 가치를 얻어야합니다.
| 가스
| 25c (mol/l atm) henry 's Law Constant
|
|
o 2
|
1.3 x 10
|
|
n 2
|
6.1 x 10
|
|
H 2
|
7.8 x 10
|
|
Co 2
|
3.4 x 10
|
표 01 :대기의 다른 가스에 대해 헨리의 법률 상수 25c
또한, 특정 가스에 대한 Henry의 법칙을 적용 할 때, 그 온도에서 물의 증기 압력을 고려하여 부분 압력을 얻어야합니다. 다음 예를 고려해 봅시다.
예
질문 : 정상적인 대기 조건에있는 호수를 고려하십시오. o 2 (g) 의 용해도를 결정하십시오 대기에서 물의 증기 압력을 0.0313ATM으로 고려하여 25C 온도 및 1ATM 대기압에서. 정상 공기는 O 2 (g)의 21%로 구성됩니다.

그림 1 :수역은 물의 온도와 대기압에 따라 다른 양으로 용해 된 가스가있는 물로 구성됩니다.
답변 :
대기에서의 산소의 부분 압력 =(1-0.0313) ATM X (21/100)
=0.20 atm
25oc =1.3 x 10mol /l atm
의 산소에 대한 헨리의 법칙 상수
헨리의 법칙을 적용;
[o (aq) ] =kh.p o2 (g)
=1.3 x 10 mol/l atm x 0.2 atm
=2.6 x 10 mol/l
상기 계산에 따르면, 정상 온도 및 압력 조건에서 수역에서 용존 산소의 양은 매우 낮습니다.
제한
헨리의 법칙은 고려되는 분자가 평형 상태 인 경우에만 사용할 수 있습니다. 더욱이이 법은 고압 조건에서는 효과가 없습니다. 또한 용해 가스가 용매와의 화학적 반응을 보이면이 법칙은 해당 시스템에 사용될 수 없습니다.
Raoult의 법률은 무엇입니까
Raoult의 법칙은 솔루션의 증기 압력과 해당 솔루션의 용질의 부분 압력 사이의 관계를 설명하는 열역학적 법칙입니다. 이 법칙은 용액 위의 용매의 증기 압력은 용매의 두더지 분율을 곱한 순수한 용매 (해당 온도에서)의 증기압과 동일하다고 말합니다.
이것은 다음과 같이 방정식에 의해 주어질 수 있습니다.
. p solute =x 용질 x p solute
여기서, p a 혼합물에서 구성 요소 A의 부분 압력,
x a 성분 A의 두더지 분율입니다
p a 같은 온도에서 순수한 성분의 증기 압력입니다.
예를 들어, A와 B의 혼합을 고려해 봅시다.
a =n a 의 두더지 분율 / (n a + n b )
a ={n a 의 부분 압력 / (n a + n b )} p a
그러므로 해당 시스템의 총 증기 압력 =p a + p b
그러나 Raoult의 법칙은 이상적인 솔루션에만 적용됩니다. 이상적인 용액은 용매 분자와 동일한 용질 분자 사이의 분자간 상호 작용을 갖는 용질로 구성됩니다. 이상적인 가스로 간주 될 수있는 실제 솔루션이 없기 때문에, 우리는이 법을 적은 양의 용질 분자를 가진 매우 희석 된 솔루션에 적용 할 수 있습니다.
. 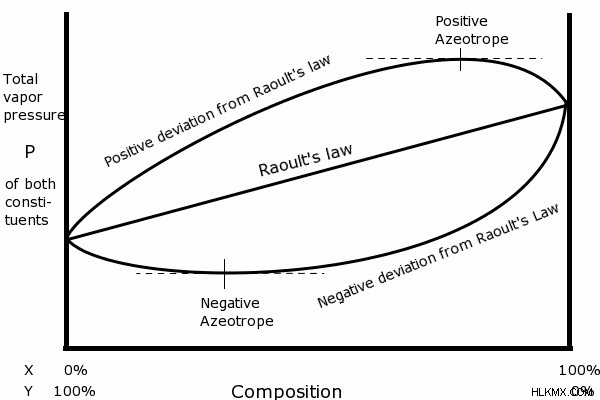
그림 2 :X 및 Y 가스로 구성된 기체 혼합물에 대한 Raoult의 법칙의 적용.
제한
용질의 두더지 분율을 계산할 때 첨가 된 화합물의 두더지 대신 용액에 존재하는 입자의 수를 고려해야합니다. 예를 들어, 이온 성 화합물이 물에 용해 될 때, 용액에서 분리되는 각 이온은 하나의 입자로 간주되어야한다 (예 :NaCl은 Na+와 Cl-inion을 제공한다. 따라서 존재하는 입자의 양은 추가 된 NaCl의 양의 양이다.)
. Henry의 법과 Raoult의 법의 차이
정의
헨리의 법칙 : Henry의 법칙은 액체 매체의 가스 용해를 설명하는 열역학적 법입니다.
Raoult의 법칙 : Raoult의 법칙은 솔루션의 증기 압력과 해당 솔루션의 용질의 부분 압력 사이의 관계를 설명하는 열역학적 법입니다.
개념
헨리의 법칙 : 헨리의 법칙은 액체에 용해 된 가스의 양은 액체와 평형을 이루는 가스의 부분 압력에 직접 비례한다고 말합니다.
Raoult의 법칙 : Raoult의 법칙은 용액 위의 용매의 증기 압력은 순수한 용매 (해당 온도에서)의 증기압과 동일하다고 말합니다.
비례 상수
헨리의 법칙 : 헨리 법의 비례 상수는 헨리의 법률 상수라고합니다.
Raoult의 법칙 : Raoult의 법칙은 비례 상수를 사용하지 않습니다.
결론
Henry의 법칙과 Raoult의 법칙은 증기 압력과 접촉하는 솔루션의 화학적 행동을 나타냅니다. Henry의 법과 Raoult의 법의 차이점은 Henry의 법칙이 해결책의 용질의 행동을 설명하는 반면 Raoult의 법칙은 솔루션에서 용매의 행동을 설명한다는 것입니다.
.