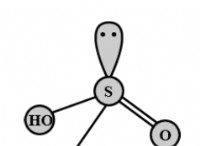
mg (s) + 2hcl (aq) → mgcl2 (aq) + h2 (g)
한편, 마그네슘 리본이 HCL과 비교하여 약한 산인 아세트산 (CH3COOH)과 반응 할 때 단일 변위 반응을 겪는다. 그러나, 반응은 아세트산의 산도가 낮기 때문에 느린 속도로 진행된다. 이 반응의 화학적 방정식은 다음과 같습니다.
Mg (S) + 2CH3COOH (AQ) → MG (CH3COO) 2 (AQ) + H2 (G)
두 반응을 비교하면 MG와 HCL 사이의 반응이 더욱 격렬하게 발생하여 더 빠른 피즈를 초래합니다. 이 차이는 관련된 산의 강도에 기인 할 수 있습니다. 염산은 물에 완전히 분리되어 고농도의 수소 이온 (H+)을 방출하는 강산입니다. 이 H+ 이온은 MG와 신속하게 반응하여 수소 가스의 빠른 생산과보다 격렬한 피즈를 유발합니다.
대조적으로, 아세트산은 물에 부분적으로 분리되는 약산이다. 이로 인해 MG와의 반응이 느리고 수소 가스의 덜 활발한 방출이 발생하여 덜 피즈가 발생합니다.