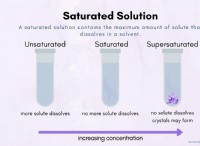
Van't Hoff 인자 (I)는 용매에 용해 될 때 물질이 분해되는 입자의 수를 측정 한 것입니다. NaCl의 경우, i =2는 na+ 및 클리온으로 분리되기 때문입니다. KNO3의 경우, i =2는 K+ 및 NO3 이온으로 분리되기 때문입니다.
용액의 비등점 높이 및 동결 지점 우울증은 모두 협업 특성이며, 이는 화학적 특성이 아닌 용액의 입자 수에 의존한다는 것을 의미합니다. 비등점 고도 (∆TB) 및 동결 지점 우울증 (∆TF)은 다음 방정식에 의해 제공됩니다.
∆tb =kb * m * i
∆tf =kf * m * i
KB가 비등점 고도 상수 인 경우, KF는 동결 지점 우울증 상수이며, M은 용액의 몰 (용매 킬로그램 당 용질의 몰)이며, 나는 반가워한 호프 인자이다.
1 M NaCl은 0.5m kNO3보다 높은 Van't Hoff 계수를 가지므로 더 큰 비등점 상승과 동결 지점 우울증을 유발할 것입니다. 따라서, 1m NaCl의 증기압은 0.5 m kNO3의 증기압보다 낮을 것이다.
요약하면, 1m NaCl의 증기 압력이 0.5m kNO3의 증기 압력보다 낮다는 진술이 올바르지 않습니다. 1 M NaCl의 증기압은 실제로 Van't Hoff 계수가 높기 때문에 실제로 더 높습니다.