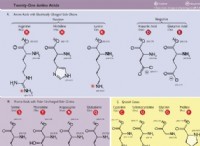
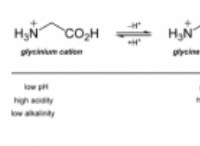
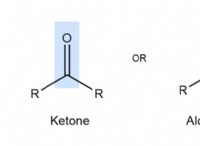
1. 개념 이해
* molality (m) : 용매 킬로그램 당 용질 몰의 수.
* 몰 분율 (χ) : 용액의 두부의 비율은 용액의 모든 성분의 총 두더지의 비율입니다.
2. 가정
* 우리는 용액 밀도가 물의 밀도 (1 g/ml)와 거의 같다고 가정합니다. 이것은 희석 된 수용액에 대한 합리적인 근사치입니다.
3. 계산
a) molality (m)
1. 용질 (HCOOH) 및 용매 (물)의 질량 :
* 100g의 용액을 가정하십시오.
* hcooh의 질량 =30.1 g
* 물 질량 =100 g -30.1 g =69.9 g
2. 용질의 두더지 (HCOOH) :
* HCOOH의 몰 질량 =46.03 g/mol
* HCOOH의 두더지 =30.1 g / 46.03 g / mol =0.654 mol
3. 몰 리티 :
* molality (m) =(용질의 몰) / (용매 kg)
* Molality (M) =0.654 mol / 0.0699 kg = 9.35 m
b) 두더지 분획 (χ)
1. 용매의 두더지 (물) :
* 물의 몰 질량 =18.02 g/mol
* 물의 몰 =69.9 g / 18.02 g / mol =3.88 mol
hcooh의 두더지 분율 :
* 두더지 분율 (χ) =(HCOOH의 몰) / (총 용액의 총 두더지)
* 두더지 분율 (χ) =0.654 mol / (0.654 mol + 3.88 mol) = 0.145
따라서, 포름산 용액의 몰은 9.35 m이고, 포름산의 두더 분율은 0.145이다. .