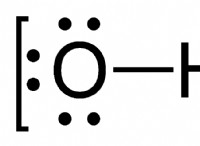다음은 고장입니다.
* dioxygen (o 2 )
* 작은 크기 : 산소 원자는 비교적 작습니다.
* 약한 분자간 힘 : o 2 분자는 비극성이며 약한 런던 분산 세력 (반 데르 발스 세력)만을 나타냅니다.
* 저 분자량 : o 2 의 분자량 32 g/mol입니다.
이러한 요인들은 이산 소 분자가 낮은 인력을 가지며 쉽게 움직일 수 있음을 의미하여 실온에서 가스를 만듭니다.
* 황 (s)
* 더 큰 크기 : 황 원자는 산소 원자보다 큽니다.
* 더 강한 분자간 힘 : 원소 황은 s 8 로 존재합니다 분자 (8 개의 황 원자가 고리에 결합) 및 더 큰 크기 및 더 큰 분극성으로 인해 더 강한 런던 분산 힘을 나타냅니다.
* 고 분자량 : s
이들 요인의 조합은 더 강한 분자간 힘과보다 컴팩트 한 구조를 초래하여 실온에서 황을 고체로 만듭니다.
요약 :
* dioxygen (o 2 ) : 작은 크기, 약한 힘, 저 분자량 => 실온에서 가스.
* 황 (s 8 ) : 더 큰 크기, 강한 힘, 고 분자량 => 실온에서 고체.