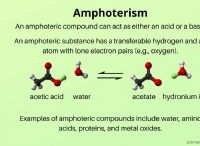
1. 강한 분자간 힘 :
* 물 분자는 극성이며, 수소 원자에 부분 양전하가 있고 산소 원자에 부분 음전하가있다.
*이 극성은 수소 결합 의 형성을 허용합니다. - 한 물 분자의 양으로 하전 된 수소와 다른 물의 음으로 하전 된 산소 사이의 강력한 관광 명소.
2. 채권을 파괴하려면 에너지가 필요합니다.
* 끓으려면 물 분자는 이러한 강한 수소 결합을 극복하고 기체상으로 빠져 나가야합니다.
* 이러한 결합을 파괴하는 데 필요한 에너지는 상대적으로 높으며, 높은 비등 지점 (100 ° C)에 기여합니다.
3. 유사한 분자와 비교 :
* 메탄 (CH4)과 같은 유사한 분자량을 가진 다른 분자를 고려하십시오.
* 메탄은 수소 결합이 없기 때문에 비등점 (-161 ° C)이 훨씬 낮습니다. 그것은 단지 런던의 약한 분산 세력을 경험합니다.
요약 :
* 수소 결합은 물에 분자간 힘의 강력한 네트워크를 생성하여 극복하고 기화하기 위해 상당한 양의 에너지가 필요합니다.
* 이것이 물이 크기의 분자에 대해 비정상적으로 높은 끓는점을 갖는 이유입니다.
수소 결합의 기타 효과 :
* 높은 용융점
* 높은 표면 장력
* 우수한 용매 특성