수소 이온 농도는 감소 할 것이다.
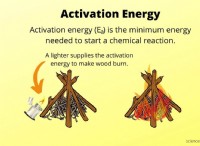
설명 :
* 강산 : 강산은 용액에서 완전히 이온화하여 모든 수소 이온 (H+)을 용액으로 방출한다는 것을 의미합니다.
* 수산화 이온 : 수산화물 이온 (OH-)은 물의 기본 성분입니다. 그들은 강한베이스입니다.
* 중화 : 강산과 강한 기본이 반응하면 서로를 중화시킵니다. 이는 산으로부터의 수소 이온 (H+)이 염기로부터 수산화물 이온 (OH-)과 반응하여 물 (H2O)을 의미한다.
반응 :
H + (산) + OH- (베이스) → H2O
결과 :
* 수산화물 이온의 첨가는 용액에서 수소 이온을 직접 소비하여 농도를 줄입니다.
* 산과 염기는 1 :1 비율로 반응하기 때문에 수소 이온에 동일한 수의 수산화 이온을 첨가하면 용액이 중립이됩니다.
* 수소 이온보다 수산화 이온을 더 첨가하면 용액이 기본화됩니다.
중요한 참고 : 용액의 최종 pH는 강산의 초기 농도 및 첨가 된 수산화물 이온의 양에 의존 할 것이다.