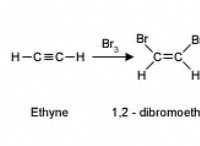
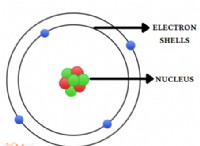
* 전자 구성 : 수소는 알칼리 금속 (그룹 1)과 유사한 가장 바깥 쪽 쉘에 전자가 하나뿐입니다. 이것은 반응성의 일부 유사성으로 이어진다.
* 원자가 전자 : 알칼리 금속과 마찬가지로, 수소는 안정적인 고귀한 가스 구성 (헬륨과 같은)을 달성하기 위해 하나의 전자를 얻기 만하면됩니다.
* 양이온 형성 : 수소는 단일 전자를 잃어 Na+또는 K+와 같은 양이온을 형성하는 알칼리 금속과 유사한 양으로 하전 된 이온 (H+)을 형성 할 수 있습니다.
그러나 수소는 또한 알칼리 금속과 크게 다릅니다.
* 비금속 특성 : 수소는 금속 알칼리 금속과 달리 비 금속입니다. 실온에서 규정형 가스 (H2)로 존재합니다.
* 전기 음성 : 수소는 대부분의 알칼리 금속보다 전기 음성 성이 높아서 특정 상황에서 전자를 얻고 음성 이온 (수 소화물 H-)을 형성 할 가능성이 높아집니다.
* 반응성 : 수소는 알칼리 금속과 같은 반응성 일 수 있지만 알칼리 금속과 달리 다른 원소와 공유 결합을 쉽게 형성합니다.
요약 :
수소는 알칼리 금속과 약간의 유사성을 공유하지만, 비금속 특성, 더 높은 전기 음성 성 및 공유 결합을 형성하는 경향이 구별되는 경향이 있습니다. 이 독특한 특성 조합은 수소를 단일 그룹으로 깔끔하게 분류하기가 어렵습니다. 그것은 종종 특별한 경우로 간주되며 주기율표의 다른 요소와 별도로 표시됩니다.