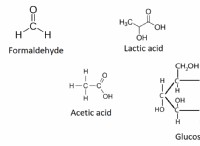
실제 가스 대 이상적인 가스
* 이상적인 가스 가정 : 이상적인 가스 법칙은 가스 분자에 부피가없고 분자간 힘이 없다고 가정합니다. 실제로, 이러한 가정은 완전히 사실이 아닙니다.
* 실제 가스 편차 : 실제 가스 분자는 유한 한 부피를 가지고 있으며, 반 분자간 힘 (Van der Waals Forces와 같은 분자간 힘)을 경험합니다.
CO2와 HCL이 개발 한 이유
* 분자간 힘 : CO2와 HCL은 모두 분자간 력이 약합니다. CO2는 주로 비극성이지만 전자 이동으로 인해 임시 쌍극자가있을 수 있습니다. HCL은 수소와 염소 사이의 전기 음성 성 차이로 인해 영구 쌍극자가 있습니다. 이 힘은 분자가 서로를 끌어 당기고 그들이 차지하는 부피를 약간 줄입니다.
* 분자 부피 : 비교적 작지만 CO2와 HCl의 분자는 유한 한 부피를 차지합니다. 이 볼륨은 총 부피, 특히 더 높은 압력에 비해 무시할 수 없습니다.
결론
이상적인 가스 값으로부터 CO2 및 HCL의 몰 부피의 약간의 편차는 분자간 힘과 분자 부피의 결합 된 효과에 기인한다. 이러한 편차는 더 높은 압력과 낮은 온도에서 더욱 중요해집니다.