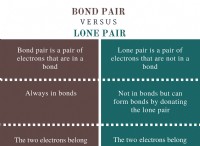
* 전자 구성 : Bromine (BR)은 [AR] 3D¹⁰ 4S² 4P⁵의 전자 구성을 갖습니다. 그것은 7 개의 원자가 전자를 가지므로 안정적인 옥셋을 달성하기 위해 하나의 전자를 얻어야한다는 것을 의미합니다. Krypton (KR)은 [ar] 3d¹⁰ 4S² 4p⁶의 전자 구성을 갖습니다. 그것은 이미 옥셋의 원자가 전자를 가지고 있으며 매우 안정적입니다.
* 이온화 에너지 : 이온화 에너지는 원자에서 전자를 제거하는 데 필요한 에너지입니다. 브롬은 크립톤보다 이온화 에너지가 낮습니다. 왜냐하면 옥틴이 전체가없는 원자에서 전자를 제거하는 것이 더 쉽기 때문입니다. 크립톤의 안정적이고 전체 옥틴은 전자를 제거하기가 훨씬 어렵습니다.
요약 : 안정적인 옥셋을 달성하는 데 더 가까운 브롬은 이미 안정적인 상태에있는 크립톤보다 가장 바깥 쪽 전자를 더 쉽게 잃게됩니다.