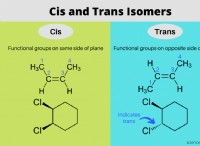
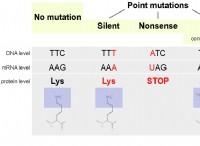
이유는 다음과 같습니다.
* 이온 반경 : 칼륨 이온 (K+)은 나트륨 이온 (Na+)보다 큽니다. 이 큰 크기는 칼륨 양이온이 전자를 약하게 유지하여 다른 물질과 반응하는 데 더 취약하다는 것을 의미합니다.
* 전기 음성 : 칼륨은 나트륨보다 전기 음성이 적습니다. 이것은 칼륨이 전자에 대한 매력이 약해서 전자를 잃고 반응에 참여할 가능성이 높다는 것을 의미합니다.
* 용해도 : 수산화 칼륨은 수산화 나트륨보다 물에 더 용해됩니다. 이러한 증가 된 용해도는 KOH가 더 쉽게 용해되어 반응에 참여하기 위해 더 많은 이온을 제공한다는 것을 의미한다.
일반적으로 반응성은 주기율표에서 그룹을 증가시킵니다. 이것은 원자 반경이 증가하여 핵과 원자가 전자 사이의 인력이 약해져 반응에 쉽게 잃고 참여할 수 있기 때문입니다.
따라서, 수산화 칼륨은 수산화 나트륨보다 주기성 테이블을 더 아래로 내리는 것이 더 반응성이다.