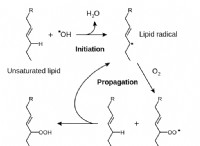
구리 (Cu)
* 원자 번호 : 29
* 전자 구성 : 1S² 2S² 2P⁶ 3S² 3P⁶ 4S¹ 3D¹⁰
설명 :
* 구리의 전자 구성은 비정상적으로 보입니다. 우리는 4S 궤도가 3D 궤도 전에 완전히 채워질 것으로 기대합니다. 그러나 반으로 채워 지거나 완전히 채워진 궤도가 더 안정적입니다. 그렇기 때문에 구리가 4S 궤도에서 전자를 "빌려"3D 궤도를 채우기 위해 더 안정적입니다.
* 이로 인해 4S 궤도에서 짝을 이루지 않은 전자 하나가됩니다.
* 파라 마그네시즘 : 짝을 이루지 않은 전자는 자기 모멘트를 생성하여 원자가 상자성을 만듭니다.
구리 (i) 이온 (cu⁺)
* 전자 구성 : 1S² 2S² 2P⁶ 3S² 3P⁶ 3D¹⁰
설명 :
* 구리 (I) 이온은 4S 궤도에서 제거 된 하나의 전자를 잃어서 형성됩니다.
* 이것은 완전히 채워진 3D 궤도와 짝을 이루지 않은 전자가없는 구리 (I) 이온을 떠납니다.
* diamagnetism : 짝을 이루지 않은 전자가없는 경우, 구리 (I) 이온은 디아마그네틱하여 자기장에 의해 약하게 반발된다.
요약 :
* 구리 (Cu) : 4S 궤도에 짝을 이루지 않은 전자의 존재는 그것을 상자성으로 만듭니다.
* 구리 (i) 이온 (cu⁺) : 4S 전자의 손실과 완전히 채워진 3D 궤도는 디아마그네시즘을 초래한다.