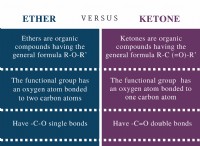
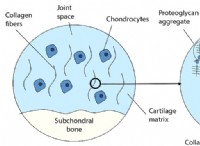
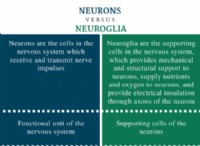
* 화학 반응성 : 원자가 전자는 화학 결합에 관여합니다. 원자는 안정적인 전자 구성을 달성하기 위해 원자가 전자를 얻거나 잃거나 공유하는 경향이 있습니다 (일반적으로 듀엣을 목표로하는 수소 및 헬륨을 제외한 옥틴). 원자가 전자의 수는 원자가 다른 원자와 얼마나 쉽게 반응 할 것인지 결정합니다.
* 금속 : 일반적으로 1-3 개의 원자가 전자를 가지며 양의 이온 (양이온)을 형성하는 경향이 있습니다. 그들은 일반적으로 열과 전기의 좋은 지휘자이며 가단성과 연성입니다.
* 비금속 : 일반적으로 4-8 원자가 전자를 가지며 전자를 얻거나 공유하여 음이온 (음이온)을 형성하는 경향이 있습니다. 그들은 일반적으로 열과 전기의 가난한 도체이며 부서지기 쉬운다.
* 메탈 로이드 : 금속과 비금속의 특성이 있으며 반응성은 다양합니다.
* 산화 상태 : 원소의 산화 상태는 화합물에서의 명백한 전하를 지칭한다. 원자가 이득, 손실 또는 공유의 원자가 전자 수와 관련이 있습니다.
* 본딩 : 원자가 전자는 요소가 형성 할 수있는 화학적 결합의 유형을 결정합니다.
* 이온 결합 : 하나의 원자가 전자 (양이온 형성)를 잃고 다른 원자가이를 얻을 때 형성됩니다 (음이온 형성).
* 공유 결합 : 원자가 원자가 전자를 공유 할 때 형성됩니다.
* 주기성 : 원자가 전자의 수는 요소의주기적인 추세에서 핵심 요소입니다. 예를 들어, 주기성 테이블의 동일한 그룹 (열)의 요소는 동일한 수의 원자가 전자를 가지므로 유사한 화학적 특성을 초래합니다.
* 전기 음성 : 전기 음성 성은 화학적 결합으로 전자를 끌어들이는 원자가 능력의 척도입니다. 원자가 보유한 원자가 전자의 수와 직접 관련이 있습니다.
요약하면, 원자가 전자는 요소의 화학적 거동, 반응성 및 결합 기능을 이해하는 열쇠입니다. 그것들은 화학 반응과 우리 주변의 세계의 다양성과 복잡성의 원동력입니다.