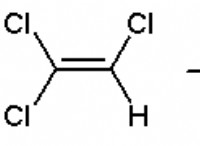
원동력으로서의 에너지 :
* 활성화 에너지 : 모든 화학 반응은 시작하기 위해 일정량의 에너지가 필요합니다. 이것을 활성화 에너지라고합니다. 반응물의 기존 결합을 깨고 새로운 결합이 형성되는 데 필요한 "푸시"라고 생각하십시오.
* 열 : 종종 열은 활성화 에너지를 제공하는 데 사용됩니다. 이것이 고온에서 많은 반응이 더 빨리 발생하는 이유입니다.
* 촉매 : 촉매는 활성화 에너지를 낮추어 공정에서 소비하지 않고 반응이 더 빨리 진행됩니다. 그것을 반응의 "도우미"로 생각하십시오.
제품으로서의 에너지 :
* 발열 반응 : 이러한 반응은 종종 열처럼 주변으로 에너지를 방출합니다. 당신은 나무를 태우거나 핸드 더운을 사용할 때 이것을 느낍니다.
* 흡열 반응 : 이 반응은 주변 환경에서 에너지를 흡수하여 주변 환경을 더 차갑게 만듭니다. 녹는 얼음을 생각하십시오 - 환경에서 열을 흡수합니다.
주요 개념 :
* 엔탈피 변화 (ΔH) : 이것은 반응 동안 열을 흡수하거나 방출합니다. 음성 ΔH는 발열 반응을 나타내고, 양성 ΔH는 흡열 반응을 나타낸다.
* 엔트로피 변경 (ΔS) : 이것은 반응 동안 시스템의 장애 또는 무작위성의 변화를 측정합니다. 반응은 엔트로피의 증가를 선호하는 경향이있다.
요약 :
에너지는 화학 반응이 발생하는 데 필수적이며 열을 방출하거나 흡수하는지 여부를 결정합니다. 에너지의 역할을 이해하면 반응 속도를 예측하고 반응 유형을 식별하며 화학 공정을 제어하는 데 도움이됩니다.