NaCl (테이블 소금)
* 이온 결합 : NaCl은 이온 결합에 의해 함께 유지됩니다. 나트륨 (NA)은 양전하가 있고 염소 (CL)는 음전하를 갖는다. 이 반대의 청구는 서로를 강력하게 끌어들입니다.
* 물의 극성 : 물 (HATE)은 극성 분자입니다. 산소 원자는 약간의 음전하를 가지며, 수소 원자는 약간의 양의 전하를 갖는다. 이것은 물 분자에서 쌍극자 모멘트를 만듭니다.
* 용해 : NaCl이 물에 배치되면 극성 물 분자는 Na+와 클리온을 둘러싸고 있습니다. 물 분자의 부정적인 끝은 Na+ 이온으로 끌리며, 물 분자의 양성 끝은 클리온으로 끌린다. 이 매력은 NaCl을 함께 유지하는 이온 결합을 극복하고 이온은 물 분자 (수화)로 둘러싸여있다. 그들은 이제 용액에서 자유롭게 움직일 수 있으며, 소금을 효과적으로 용해시킵니다.
에탄올 (c₂h₅oh)
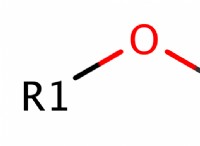
* 수소 결합 : 에탄올은 물 분자와 수소 결합을 형성 할 수있는 하이드 록실 그룹 (-OH)을 함유한다. 이러한 결합은 비교적 강하고 물에서 에탄올의 용해도에 기여합니다.
* 극성 : 에탄올은 비극성 탄화수소 사슬 (C₂H₅-)을 가지고 있지만, -OH 그룹은 분자에서 극성 영역을 생성한다. 이 극성은 극성 물 분자와 상호 작용하여 용해도를 초래할 수 있습니다.
중요한 참고 : 물질이 물에 용해되는 정도는 용질과 용매 (물) 사이의 인력의 힘 사이의 균형과 용질 분자 자체 사이의 인력의 힘 사이의 균형에 의존한다.
* naCl : Na+와 Cl- 사이의 강한 이온 결합은 이들 이온과 극 물 분자 사이의 더 강한 인력에 의해 극복된다.
* 에탄올 : 에탄올 분자 사이의 수소 결합은 에탄올과 물 사이에 형성 될 수있는 수소 결합에 비해 상대적으로 약하다.
요약하면, 물의 극성 성질과 수소 결합을 형성하는 능력은 NaCl과 같은 이온 성 화합물과 에탄올과 같은 극성 분자 모두에 좋은 용매가된다. .