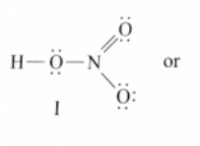
염소 (CL) :
* 전자 구성 : 염소에는 17 개의 전자가 있으며, 구성 [NE] 3S² 3P⁵. 이것은 가장 바깥 쪽 쉘에 7 개의 전자가 있음을 의미합니다.
* 옥트 규칙 : 안정적인 옥셋을 달성하기 위해 염소는 하나 더 전자가 필요합니다. 그것은 전자가 Cl⁻이되기 위해 얻어졌으며, 이제 고귀한 가스 아르곤 (AR)과 동일한 전자 구성을 갖습니다.
황 (s) :
* 전자 구성 : 유황에는 16 개의 전자가 있으며, 구성 [NE] 3S² 3P⁴. 가장 바깥 쪽 쉘에 6 개의 전자가 있습니다.
* 옥트 규칙 : 안정적인 옥셋을 달성하기 위해 황은 2 개의 전자가 더 필요합니다. 그것은 두 개의 전자가 s²⁻가되도록 얻습니다. 이제 고귀한 가스 아르곤 (AR)과 동일한 전자 구성을 갖습니다.
요약 :
* 염소는 안정적인 옥셋을 달성하기 위해 하나의 전자를 얻어야하므로 -1 이온을 형성합니다.
* 황은 안정적인 옥셋을 달성하기 위해 2 개의 전자를 얻어야하므로 -2 이온을 형성합니다.
이것들은 염소와 황에 가장 흔한 이온 형태라는 점에 유의해야합니다. 그것들은 주로 -1 및 -2 이온을 형성하지만, 다른 산화 상태를 채택 할 수있는 다른 화학 반응에 참여할 수 있습니다.