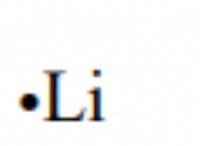1. 농도 : 더 높은 농도의 용질은 용액에 더 많은 이온이 존재한다는 것을 의미한다.
2. 공식 단위 당 생성 된 이온의 수 : 일부 화합물은 물에 용해 될 때 다른 화합물보다 더 많은 이온으로 분리됩니다.
예 :
* 0.1 M NaCl : 염화나트륨 (NaCl)은 포뮬러 단위 당 2 개의 이온 (Na+ 및 Cl-)으로 분리됩니다. 따라서, 0.1m 용액은 리터당 0.2 몰의 이온을 함유 할 것이다.
* 0.1 M CaCl2 : 염화 칼슘 (CACL2)은 공식 단위 당 3 개의 이온 (Ca2+ 및 2Cl-)으로 분리됩니다. 0.1m 용액은 리터당 0.3 몰의 이온을 함유 할 것이다.
따라서, 0.1m의 CaCl2 용액은 0.1m NaCl 용액에 비해 공식 유닛 당 더 많은 이온을 생성하기 때문에 가장 많은 수의 이온을 포함 할 것이다. .
일반 규칙 :
가장 많은 이온이있는 용액을 찾으려면 다른 용액의 농도를 비교하고 용해시 각 화합물이 생산하는 이온의 수를 고려하십시오. 포뮬러 단위 당 농도의 농도 및 이온의 수가 가장 높은 솔루션은 가장 많은 이온을 가질 것입니다.