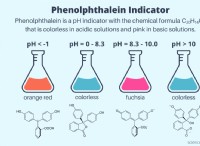
다음은 반응을 기록 해야하는 이유와 방법입니다.
정확한 반응 :
2 li (s) + 2 naoh (aq) → 2 lioh (aq) + 2 na (s)
설명 :
* 리튬 (li) 반응성이 높은 알칼리 금속입니다. 수산화 리튬 (LiOH) 및 수소 가스 (HAT)를 형성하기 위해 물 (및 NAOH 용액)과 격렬하게 반응합니다.
* 나트륨 (NA) 또한 알칼리 금속이지만 리튬보다 반응성이 적습니다. 수산화 나트륨 (NAOH)과 수소 가스 (HAT)를 형성하기 위해 물과 반응합니다.
* 수산화 나트륨 (NAOH) 강력한 기지입니다. 수산화물 이온 (OH-) 및 나트륨 이온 (Na+)을 형성하기 위해 물에 용해됩니다.
산화 상태 변화 :
* 리튬 (li) 산화 상태가 0 인 중성 요소로 시작됩니다. lioh에서는 산화 상태가 +1입니다. 따라서 li는 산화된다 이 반응에서.
* 나트륨 (NA) NAOH에서 +1 산화 상태로 시작하여 산화 상태가 0 인 중성 요소로 끝납니다. 따라서 NA가 감소됩니다 . 이 반응에서.
키 포인트 :
반응은 산화 환원 반응 이다 . 리튬은 산화되고 (전자 손실) 나트륨이 감소합니다 (전자 게인). 이것은보다 반응성 금속 (Li)이 화합물로부터 덜 반응성 금속 (Na)을 대체하는 변위 반응의 전형적인 예입니다.