화학 반응에 에너지가 필요한 이유
화학 반응은 화학 결합의 파손 및 형성을 포함합니다. 이러한 프로세스에는 에너지가 필요합니다.
* 채권 파괴에는 에너지가 필요합니다. 기존 결합은 원자를 함께 유지하고이를 깨뜨리려면 매력을 극복하기 위해 에너지 입력이 필요합니다.
* 채권 형성은 에너지를 방출합니다 : 새로운 결합이 형성되면, 새로운 배열에서 원자가 더 안정적이 될 때 에너지가 방출됩니다.
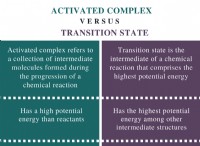
여기 핵심 요점이 있습니다 : For a chemical reaction to proceed, the energy released by bond formation must be greater than the energy required to break the initial bonds. 이 차이를 활성화 에너지 라고합니다 반응이 발생하는 데 필요한 최소 에너지입니다.
언덕 위로 공을 밀는 것처럼 생각하십시오 :
* 공은 반응물을 나타냅니다.
* 언덕은 활성화 에너지를 나타냅니다.
* 새로운 결합을 형성하여 방출 된 에너지는 반대편의 내리막 길이와 같습니다.
충분한 에너지 (활성화 에너지)로 공을 밀지 않으면 언덕 위로 가지 않으며 반응은 일어나지 않을 것입니다.
화학 반응을위한 일반적인 에너지 공급원
다음은 화학 반응을 주도 할 수있는 몇 가지 일반적인 에너지 원입니다.
1. 열 : 온도가 증가하면 더 많은 운동 에너지가있는 분자를 제공하여 활성화 에너지 장벽을 극복 할 수 있습니다.
2. 빛 : 특정 파장의 빛, 특히 자외선은 화학 결합을 파괴하고 반응을 시작하기에 충분한 에너지를 제공 할 수 있습니다. 식물이 음식을 만들기 위해 사용하는 과정 인 광합성이 그 예입니다.
3. 전기 : 전류를 적용하면 자발적으로 발생하지 않는 반응을 구동하는 데 필요한 에너지를 제공 할 수 있습니다. 이것은 전기 분해와 같은 과정에서 사용됩니다 (물을 수소와 산소로 분해 함).
4. 화학 에너지 : 연료 연소와 같은 화학 물질 간의 반응, 다른 반응을 주도하는 데 사용할 수있는 에너지를 방출합니다. 이것이 우리 몸이 음식으로부터 에너지를 얻는 방법입니다.
원자력 : 핵분열 및 융합과 같은 원자력은 대량의 에너지를 방출하며, 이는 전기를 생성하거나 다른 공정을 전력을 공급하기 위해 활용 될 수 있습니다.
요약하면, 에너지는 기존의 결합을 깨고 새로운 결합을 형성하는 과정을 시작해야하기 때문에 화학 반응에 필수적입니다. 다양한 에너지 원을 사용하여 반응에 필요한 활성화 에너지를 제공하여 광합성에서 전기 생산에 이르기까지 모든 것에서 중요한 역할을합니다.