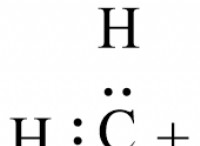밀도에 영향을 미치는 요인 :
* 원자 크기 : 더 큰 원자는 일반적으로 밀도가 낮습니다. 공유 화합물은 종종 유사한 크기의 원자를 포함하는 반면, 이온 성 화합물은 종종 큰 양이온과 작은 음이온을 포함합니다. 이 크기의 차이는 밀도에 영향을 줄 수 있습니다.
* 결합 강도 : 더 강한 결합은 일반적으로 더 높은 밀도를 초래합니다. 이온 결합은 일반적으로 공유 결합보다 강합니다.
* 포장 효율 : 얼마나 단단히 원자가 함께 포장되는지도 밀도에 영향을 미칩니다. 이온 성 화합물은 종종 공유 화합물보다 더 효율적인 포장 구조를 갖는다.
* 분자간 힘 : 공유 화합물에서, 분자간 력 (수소 결합 또는 반 데르 발스 힘)은 밀도에서 역할을 할 수있다. 이 힘은 분자가 더 밀접하게 포장되어 밀도가 높아질 수 있습니다.
예외 및 예 :
* 다이아몬드 : 다이아몬드는 매우 강한 공유 결합과 매우 높은 밀도 (3.52 g/cm³)를 갖는 공유 네트워크 고체입니다.
* 큰 양이온을 갖는 이온 성 화합물 : 요오드화 칼륨 (KI)과 같은 일부 이온 성 화합물은 비교적 큰 양이온을 가지며 일부 공유 화합물보다 밀도가 낮을 수 있습니다.
일반 트렌드 :
* 간단한 공유 화합물 : 일반적으로 단순한 이온 성 화합물보다 밀도가 낮습니다. 이것은 종종 공유 구조의 약한 결합과 덜 효율적인 포장 때문입니다.
* 네트워크 공유 고체 : 강력하고 확장 된 공유 네트워크로 인해 밀도가 매우 높을 수 있습니다.
* 금속 결합 : 금속 결합은 금속의 유형과 그 구조에 따라 가변 밀도를 가질 수 있습니다.
결론 :
공유 결합이 이온 결합보다 밀도가 낮다고 말하는 것은 항상 정확한 것은 아닙니다. 밀도는 여러 요인에 의해 영향을받으며 일반적인 추세에는 예외가 있습니다.