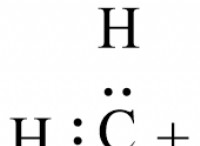* 원자 구조 : 탄소는 4 개의 원자가 전자를 가지고 있으며, 이는 다른 원자와 4 개의 공유 결합을 형성 할 수 있음을 의미합니다. 이 능력은 방대한 배열의 결합 배열을 허용합니다.
* 혼성화 : 탄소 원자는 원자 궤도가 결합되어 다른 모양과 에너지를 갖는 새로운 하이브리드 궤도를 형성하는 하이브리드 화를 겪을 수 있습니다. 이것은 탄소 기반 구조에서 다른 형상을 허용합니다.
* 동반자 : 순수한 탄소의 다른 형태를 동종 트로프라고합니다. 이들은 각각 고유 한 특성을 가진 동일한 요소의 다른 구조적 변형입니다.
다음은 탄소 동종 호수 및 그 특성의 몇 가지 예입니다.
* 다이아몬드 : 탄소 원자의 고도로 구성된 3 차원 네트워크는 사면체로 결합된다. 이 구조는 다이아몬드를 가장 열전 전도성과 굴절률로 가장 잘 알려진 천연 물질로 만듭니다.
* 흑연 : 탄소 원자가 육각형 고리에 결합되는 층 구조는 반 데르 발스 힘에 의해 약하게 유지되는 시트를 형성한다. 이를 통해 층 사이의 쉽게 미끄러질 수 있으므로 흑연을 우수한 윤활제와 전기 도체로 만듭니다.
* Fullerene : 펜타곤과 헥사 곤에 배열 된 탄소 원자로 구성된 폐쇄 케이지 구조. Fullerenes는 높은 전기 전도도 및 의학 및 재료 과학의 잠재적 응용을 포함하여 고유 한 특성을 가지고 있습니다.
* 탄소 나노 튜브 : 롤업 그래 핀 시트의 원통형 구조, 탁월한 강도, 전기 전도도 및 열전도율을 갖습니다.
이러한 다양한만큼의 배반량의 존재는 탄소의 놀라운 적응성과 고유 한 특성을 가진 놀라운 구조물을 형성하는 능력을 강조합니다. 이것은 탄소를 매우 단단한 다이아몬드에서 유연성 및 전도성 그래 핀에 이르기까지 다양한 천연 및 합성 물질의 기본 요소로 만듭니다.