1. 반응을 이해하십시오
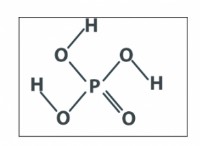
황산 (HASOA)은 중화 반응에서 수산화 나트륨 (NAOH)과 반응합니다.
h₂so₂ (aq) + 2naoh (aq) → na₂so₄ (aq) + 2h₂o (l)
2. 화학량 측정법
균형 방정식은 1 몰의 황산이 2 몰의 수산화 나트륨과 반응 함을 보여준다. 이것이 우리가 사용할 주요 화학량 론적 비율입니다.
3. NaOH의 두더지를 계산합니다
* naoh의 몰토리티 : 0.1023 m
* Naoh의 양 : 14.23 ml =0.01423 l
* Naoh의 두더지 : (0.1023 mol/l) * (0.01423 L) =0.001454 몰
4. h ofso₄의 두더지를 계산하십시오.
* Naoh의 두더지 : 0.001454 몰
* 두더지 비율 (naoh :h₂so₄) : 2 :1
* h₂so₄의 두더지 : (0.001454 Moles naoh) * (1 MOLE HASSOAT / 2 MOLES NAOH) =0.000727 MOLES HALES HASSOAT
5. holarso₄ 의 몰비를 계산하십시오
* h₂so₄의 두더지 : 0.000727 몰
* h>so₄의 볼륨 : 10.00 ml =0.01000 l
* h₂so₄의 콜라이트 : (0.000727 몰) / (0.01000 L) = 0.0727 m
따라서 황산 용액의 몰토리성은 0.0727 m입니다.