정확한 값은 온도 및 압력 조건에 따라 다릅니다. 그러나 다음은 고장입니다.
단순화 된 반응 :
ch₄ (g) + h go (g) → Co (g) + 3h₂ (g)
표준 엔탈피 변화 (ΔH °) :
25 ° C 및 1 ATM 압력에서 표준 엔탈피 변화 (ΔH °)는 대략 +206 kJ/mol 입니다. .
반응 열에 영향을 미치는 요인 :
* 온도 : 온도가 높을수록 반응이 더 흡열됩니다.
* 압력 : 압력 증가는 일반적으로 역 반응 (메탄 화)을 선호하여 반응이 흡열성을 줄입니다.
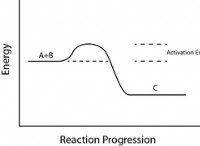
* 촉매 : 촉매 (일반적으로 니켈)의 존재는 활성화 에너지를 낮추지 만 전체 엔탈피 변화를 변화 시키지는 않습니다.
실제 고려 사항 :
산업용 증기 개혁에서, 공정은 일반적으로 반응 속도를 최대화하기 위해 고온 (약 700-900 ° C)에서 작동합니다. 필요한 열은 종종 메탄 사료의 일부를 태워서 제공됩니다.
참고 : 이 응답은 일반적인 개요를 제공합니다. 정확한 계산을 위해서는 특정 운영 조건에 대해 자세한 열역학적 데이터 테이블 또는 특수 소프트웨어를 참조해야합니다.