비정상적인 용해도 추세 :
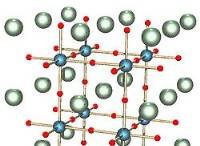
염화나트륨은 비정상적인 용해도 경향을 나타냅니다 대부분의 다른 이온 성 화합물에 비해. 온도가 증가함에 따라 대부분의 이온 성 화합물이 물에 더욱 용해되지만, 온도에 따라 염화나트륨의 용해도가 거의 변하지 않습니다 . .
설명 :
* NaCl의 용해 : NaCl이 물에 용해되면 Na+와 클리온 사이의 강한 정전기력이 중단됩니다. 극성의 성질로 물 분자는 이온을 둘러싸고 그것들을 떼어내어 수화 된 이온 (Na+(aq) 및 cl- (aq))를 형성합니다.
* 용해의 엔탈피 : 용해 과정은 흡열이므로 주변에서 열을 흡수합니다.
* 용해의 엔트로피 : 이온이 더 분산 될 때 NaCl이 용해 될 때 용해의 엔트로피 또는 무작위성의 정도가 증가합니다.
* 깁스 자유 에너지 : 물질의 용해도는 엔탈피 (ΔH) 및 엔트로피 (ΔS)와 관련된 깁스 자유 에너지 (ΔG)의 변화에 의해 결정된다.
ΔG =ΔH- TΔS
* NaCl의 용해도 : NaCl의 경우, 용해의 엔탈피는 양성 (흡열)이지만 용해의 엔트로피도 양성이고 중요합니다. 온도가 증가함에 따라, TΔS 항은 더욱 우세하여 약간 음의 ΔG를 초래한다. 그러나 엔탈피 변화도 비교적 작기 때문에 용해도의 증가는 매우 작습니다.
결론 :
염화나트륨의 비정상적인 용해도 경향은 용해의 비교적 작은 엔탈피 변화와 상당한 엔트로피 변화에 기인하며, 이는 온도가 증가함에 따라 서로 균형을 맞추고 있습니다. 이는 대부분의 다른 이온 성 화합물과 달리 온도에 따른 용해도의 최소한의 변화를 초래합니다.