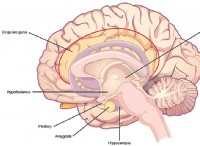
* 공동 속성 : 끓는점의 변화는 공동 속성의 결과이며, 이는 특정 동일성이 아니라 용해 된 입자의 농도에 달려 있음을 의미합니다.
* 소금의 해리 : 염 (NaCl)이 물에 용해되면 나트륨 이온 (Na+) 및 클로라이드 이온 (Cl-)으로 분리됩니다. 이 이온은 물 분자로 둘러싸여 있습니다.
* 기화와의 간섭 : 이들 이온의 존재는 물 분자 사이의 정상적인 상호 작용을 방해한다. 이것은 물 분자가 증기 상으로 빠져 나가기가 더 어려워 지므로 끓는 데 필요한 것입니다.
* 더 높은 에너지 필요 : 결과적으로, 매력을 극복하고 물이 끓을 수 있도록 더 많은 에너지 (더 높은 온도)가 필요합니다.
요약 : 용해 된 이온이 물 분자의 증기 능력을 방해하기 때문에 물에 소금을 첨가하면 비등점이 증가합니다. 즉, 물을 끓이기 위해 물을 더 높은 온도로 가열해야합니다.