우리가 알아야 할 것
* 농도 : pH를 계산하기 위해, 우리는 완충 용액에서 나트륨 아세테이트 (ch₃coona)와 아세트산 (ch₃cooh)의 농도를 알아야한다.
* 10 ml의 나트륨 아세테이트를 언급했지만이 용액의 농도를 지정하지 않았습니다.
* 당신은 "1 아세트산"이라고 말했고, 이는 농도 측면에서 의미가 없습니다.
* Henderson-Hasselbalch 방정식 : 이것은 버퍼의 pH를 계산하기위한 주요 방정식입니다.
pH =pka + log ([a⁻]/[ha])
어디:
* pH는 완충액의 pH입니다
* PKA는 약산 (이 경우 아세트산)의 산 해리 상수 (ka)의 음의 로그입니다.
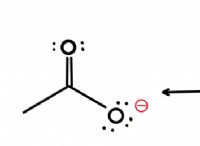
* [a concentr]는 컨쥬 게이트 염기의 농도 (아세테이트 나트륨)입니다.
* [ha]는 약산 (아세트산)의 농도입니다.
pH를 계산하는 방법
1. 아세트산의 PKA를 찾으십시오 : 테이블이나 온라인에서 아세트산 PKA를 찾을 수 있습니다. 아세트산의 PKA는 대략 4.75입니다.
2. 농도 결정 :
* 나트륨 아세테이트 용액 (예 :0.1m)의 몰토리성을 알고 있다면 아세테이트 나트륨 몰을 계산할 수 있습니다.
두더지 (아세테이트 나트륨) =어금니 (아세테이트 나트륨) x 부피 (아세테이트 나트륨)
* 아세트산 용액의 농도를 알아야합니다.
3. Henderson-Hasselbalch 방정식을 바르십시오 :
* pka, [a⁻] 및 [ha]의 값을 방정식에 꽂고 ph를 해결하십시오.
예
당신이 가지고 있다고 가정 해 봅시다 :
* 10 ml의 0.1m 나트륨 아세테이트
* 10 ml의 0.2 m 아세트산
pH를 계산하는 방법은 다음과 같습니다.
1. pka : 아세트산의 PKA는 4.75입니다.
2. 농도 :
* 두더지 (아세테이트 나트륨) =0.1 m x 0.01 L =0.001 몰스
* 두더지 (아세산) =0.2 M x 0.01 L =0.002 몰
* 부피가 부가라고 가정하면, 완충액의 총 부피는 20 mL (0.02 L)입니다.
* 농도 (아세테이트 나트륨) =0.001 몰 / 0.02 L =0.05 m
* 농도 (아세트산) =0.002 몰 / 0.02 L =0.1 m
3. Henderson-Hasselbalch 방정식 :
* pH =4.75 + 로그 (0.05 m / 0.1 m)
* pH =4.75 + 로그 (0.5)
* pH ≈ 4.45
중요한 메모 :
* 농도를 계산할 때 올바른 단위 (몰 및 리터)를 사용해야합니다.
* 버퍼 솔루션의 pH는 특정 범위 내에서 비교적 안정적입니다. 이 범위는 약산의 PKA 및 컨쥬 게이트 염기 및 산 농도의 비율에 의해 결정된다.
나트륨 아세테이트와 아세트산 용액의 농도가 있는지 알려 주시면 pH를 계산할 수 있습니다!