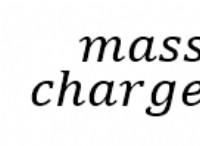황 (s)
* 전체 구성 : 1S² 2S² 2P⁶ 3S² 3P⁴
* 속기 구성 : [NE] 3S² 3p⁴
수은 (HG)
* 전체 구성 : 1S² 2S² 2P⁶ 3S² 3S² 4S² 3D¹⁰ 4P⁶ 5S² 4D¹⁰ 5P⁶ 6S² 4F¹⁴ 5D¹⁰
* 속기 구성 : [xe] 4f¹e 5d¹⁰ 6s²
전자 구성의 설명 :
* 전자 구성 : 이것은 원자의 에너지 수준과 하위 벨 내에 전자의 배열을 설명합니다.
* 주요 에너지 수준 (n) : 숫자 (1, 2, 3 등)로 표시되는 이는 핵으로부터의 전자의 상대 거리를 나타냅니다.
* sublevels : 글자 (S, P, D, F)는 주요 에너지 수준 내에서 전자 궤도의 다른 모양을 나타냅니다.
* 슈퍼 스크립트 : 각 sublevel 이후의 슈퍼 스크립트는 해당 SUBLEVEL을 차지하는 전자의 수를 나타냅니다.
속기 구성 :
속기 구성은 이전 고귀한 가스 요소의 구성을 쓰기를 단순화하기위한 시작점으로 사용합니다. 예를 들어, [NE]는 네온의 전체 전자 구성을 나타냅니다 (1S² 2S² 2P⁶).
참고 : 수은은 6S 궤도가 채워 지더라도 부분적으로 채워진 5D 궤도를 가진 독특한 요소입니다. 이것은 더 무거운 요소에 중요한 상대 론적 영향으로 인한 것입니다.