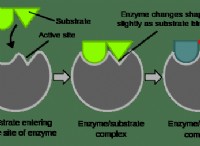
1. 효소 :
* 효소는 생물학적 촉매이다 이는 반응이 발생하는 데 필요한 활성화 에너지를 낮추어 반응을 가속화합니다.
* 그들은 활성화 에너지가 낮은 대안적인 반응 경로를 제공함으로써이를 수행합니다.
* 효소는 매우 특이 적이며 특정 유형의 반응 만 촉진합니다.
2. 온도 :
* 온도 증가는 일반적으로 반응 속도를 증가시킵니다.
* 이것은 더 높은 온도가 분자에 더 많은 에너지를 제공하여 충돌 가능성과 성공적인 반응을 증가시키기 때문입니다.
그러나 과도한 열은 효소를 변성시켜 효과가 없도록 할 수 있습니다.
3. 반응물의 농도 :
* 높은 농도의 반응물이 더 자주 충돌하여 반응 속도를 증가시킵니다.
* 반응에 참여할 수있는 반응물 분자가 더 많기 때문입니다.
4. pH :
* 효소는 최적의 pH 범위를 가지고 있습니다.
* 최적의 pH와의 편차는 효소 활성에 영향을 줄 수 있으며, 잠재적으로 반응을 늦추거나 효소를 변성시킬 수 있습니다.
5. 표면적 :
* 반응물의 표면적을 증가 시키면 반응 속도가 증가 할 수 있습니다.
* 이것은 더 많은 반응물 분자가 노출되어 충돌 할 수 있기 때문입니다.
6. 보조 인자 및 코엔자임 :
* 일부 효소는 보조 인자 (금속 이온) 또는 코엔자임 (유기 분자)이 기능합니다.
*이 분자들은 효소가 촉매 활성을 수행하여 반응의 속도를 높이는 데 도움이됩니다.
7. 기판 특이성 :
* 효소는 기질에 대해 매우 특이 적이다.
* 이것은 그들이 특정 분자와 반응에 결합하고 반응의 효율을 증가 시킨다는 것을 의미합니다.
8. 알로 스테 릭 규제 :
* 일부 효소는 알로 스테 릭 이펙터에 의해 조절됩니다.
*이 이펙터는 활성 부위 이외의 부위에서 효소에 결합하여 모양과 활동을 변경합니다.
* 이것은 반응 속도를 증가 시키거나 감소시킬 수 있습니다.
이러한 요인의 상대적 중요성은 특정 반응 및 발생하는 조건에 따라 다를 수 있습니다.