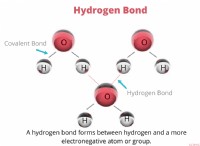
다음은 고장입니다.
반응 :
2SO 2 + o 2 → 2SO 3
키 포인트 :
* 촉매 : 이 반응은 일반적으로 합리적인 속도로 진행하기 위해 촉매가 필요합니다. 일반적인 촉매는 다음을 포함합니다.
* 바나듐 펜 옥사이드 (V 2 o 5 ) : 이것은 산업 공정에서 가장 널리 사용되는 촉매입니다.
* 플래티넘 : 또한 촉매 역할을 할 수 있지만 비용이 더 높기 때문에 덜 일반적입니다.
* 조건 : 반응은 일반적으로 고온 (약 400-500 ° C)과 압력에서 수행됩니다.
* 중요성 : 이산화황 산화는 황산의 생산에 중요한 단계입니다 (H 2 그래서
메커니즘 :
반응의 메커니즘은 복잡하며 몇 단계를 포함합니다. 그러나 전체 프로세스는 다음과 같이 단순화 할 수 있습니다.
1. 흡착 : 이산화황 및 산소 분자는 촉매의 표면에 흡착된다.
2. 반응 : 흡착 된 분자는 반응하여 트라이 산화 황을 형성합니다.
3. 탈착 : 황 삼산화황 분자는 촉매 표면으로부터 탈취된다.
환경 문제 :
이산화황은 주요 대기 오염 물질입니다. 대기 중 산화는 산성 비가 형성되어 생태계, 건물 및 인프라를 손상시킬 수 있습니다.
요약 :
이산화황 산화는 황산을 생산하는 데 중요한 산업 공정입니다. 여기에는 촉매의 존재 하에서 및 특정 조건 하에서 이산화황이 트라이 산화 황으로의 전환을 포함한다. 이 반응은 많은 산업에 필수적이지만 대기 오염과 산성비 형성에도 중요한 역할을합니다.