화학 반응은 반응물이라는 다른 요소와 반응함으로써 새로운 화학 물질을 형성하는 과정이거나, 그것이 새로운 물질을 형성하기 위해 요소를 결합하는 과정이라고 말할 수있다. 화학 반응은 두 가지 요소를 가지고 있으며, 하나는 서로 반응하고 화학적 변화를 겪는 "반응물"이라고하며, 다른 하나는 그 반응의 결과로 생성되는 "제품"입니다. 한 가지 화학 반응 예는 NA와 CL의 반응에 의해 생성되는 NACL 생산입니다.
- 서로 반응하여 새로운 요소를 생성하기 위해 두 화합물의 융합.
- 화학 반응은 일반적으로 요소의 화학적 특성을 변화시킵니다.
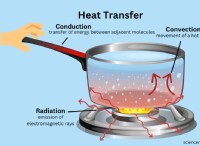
- 화학 반응 중에 색상 변화, 강수량 형성, 열 및 화재 생산과 같은 일부 물리적 변화도 관찰되고 있습니다.
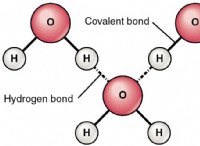
- 화학 반응 동안 원자 사이에 존재하는 결합은 가역적이거나 돌이킬 수없는 완전히 새로운 화합물을 형성합니다.
- 반응 속도는 항상 요소의 특성, 결합의 강도 및 온도, 압력 및 빛을 포함한 다른 외부 요인에 달려 있습니다.
- 물리적 변화
- 화학적 변화
다른 변화에 대한 설명 :
| 화학적 변화 | 물리적 변화 |
| 화학적 반응 후 새로운 화학적 특성으로 새로운 물질이 형성 될 때 변화를 화학적 변화라고 불립니다 | 그러한 요소의 생산이 발생하지 않으면 변화를 물리적 변화라고합니다. | .
| 예 :종이를 태운 후, 이전 상태로 되돌릴 수없는 탄소가 생산됩니다. | .예 :얼음의 용융이 물리적 특성이 바뀌지 만 화학적 특성은 동일하게 물에 빠졌습니다. |