산화 알루미늄은 알루미나로도 알려져 있으며 화학적 공식은 Al2O3입니다. 때로는 Alundum, Aloxide 또는 Aloxite라고도합니다. 비정질 물질이며 냄새가없고 흰색으로 보이며 불활성입니다. 이 화합물은 물에 불용성이며 열적으로 불안정합니다. 또한 산 및 염기 모두와 반응합니다. 따라서 수륙 양용입니다. 본질적으로 Alumina는 자연적으로 Corundum, Sapphire, Emerald 및 Ruby에서 찾을 수 있습니다. Alumina의 일상적인 사용은 산업 세라믹의 응용 분야입니다. 또한 절단 도구와 경도로 인해 연마제로 사용됩니다.
산화 알루미늄 제조
바이어의 과정은 알루미나를 생산하는 데 사용됩니다. 이 과정에는 다음 단계가 포함됩니다.
- 소화 - 보크 사이트 광석 (al2o3.2h2o)은 부서지고 가성 소다 (Naoh)로 가열됩니다. 이 용액은 고압 하에서 140-150C에서 2-8 시간 동안 가열된다. 가열되는 탱크를 소화조라고합니다. 알루미나는 본질적으로 수륙 양용이기 때문에, 수성 NAOH 용액과 반응하여 나트륨 알루미 네이트를 형성한다. 이 단계에 대한 반응은 다음과 같이 설명 할 수 있습니다.

- 여과 - 보크 사이트에는 알루미나와는 별도로 다른 성분이 포함되어 있으며,이 성분은 가축산에 용해되지 않습니다. 용해되지 않은 구성 요소는 소화조의 바닥에 빨간 진흙으로 정착합니다. 이 진흙은 여과를 통해 제거됩니다.
- 침전 - 하이드 록 사이드 알루미늄은 나트륨 알루미 네이트 용액 (Naalo2)을 물로 희석하고 혼합물을 50C로 냉각시킬 때 침전물로서 얻어진다. 이 단계에 대한 반응은 다음과 같이 설명 할 수 있습니다.

- 소성-이전 단계로부터 얻은 수산화 알루미늄은 여과, 세척, 건조, 1010-1260C에서 소환기에서 가열된다. 이것은 산화 알루미늄을 제공합니다. 이 단계에 대한 반응은 다음과 같이 설명 할 수 있습니다.

구조
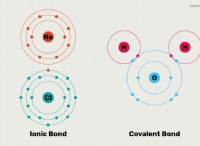
알루미나의 구조는 2 개의 알루미늄 원자와 3 개의 산소 원자로 구성됩니다. 각각의 알루미늄 원자는 +3의 양전하를 얻기 위해 3 개의 전자를 잃고, 각각의 산소 원자는 2 개의 전자를 얻기 위해 -2의 음전하를 얻습니다. 금속 (알루미늄)은 전자를 비 금속 (산소)으로 잃어 버리기 때문에 이온 성 화합물을 형성합니다. Al2O3의 도트 구조는 다음과 같이 설명 될 수 있습니다.

물리적 특성
산화 알루미늄의 물리적 특성은 다음과 같습니다.
- 그것은 101.96 g · mol -1 의 몰 질량을 가지고 있습니다
- 끓는점은 2,977 ° C입니다.
- 밀도는 3.95–4.1 g/cm3입니다.
- 그것은 단단한 재료입니다.
- 전기에 내성이 있습니다.
- 열 팽창이 낮습니다.
- 부식 지구력이 있습니다.
화학적 특성
- 물과의 반응 - Al2O3의 산화물 이온은 강하게 고정되어 물과 반응하지 않습니다. 이것은 Al2O3를 물에 불용성합니다.
- 산과의 반응 - AL2O3는 산화물 이온의 존재로 인해 산과 반응한다. 예를 들어, 희석 된 염산과 반응하면 염화 알루미늄과 물을 제공합니다. 산과 반응 할 때는 기본 역할을합니다.

- 염기와의 반응 - AL2O3도 염기와 반응합니다. 염기와 반응 할 때 산 역할을합니다. 예를 들어, 수산화 나트륨과 반응하면 나트륨 알루미 네이트 및 물을 형성합니다.

사용
알루미나는 다음 분야에서 사용됩니다 :
- 의료 산업-의학에서 Alumina는 고관절 교체 베어링, 조직 강화, 보철물, 바이오닉 임플란트, 피과 임플란트, 용광로 및 도가니와 같은 실험실 장비의 재료로 사용됩니다.
- 군사 및 보호 장비 - 알루미나는 방탄복과 같은 일부 군사 장비에 사용됩니다. 항공기 갑옷, 차량 갑옷 및 방탄 창과 같은 보호 장비에도 사용됩니다. 이것은 가벼운 특성과 힘 때문입니다.
- 전자 산업 - 알루미나는 전기 절연체 및 용광로 절연을 제조하는 데 사용됩니다. 이것은 녹는 점과 끓는점이 높기 때문입니다. 또한 마이크로 칩 산업에서 알루미나 필름 형태로 사용됩니다. 전자 산업에서 Alumina의 다른 응용 프로그램에는 단열 방열 싱크, 점화 플러그 절연체 및 미세 전기 기판이 포함됩니다.
- 보석 산업 - 알루미나의 결정질 형태 인 Corundum은 루비와 사파이어의 기본 요소입니다. 루비와 사파이어는 모두 소중한 보석입니다. 그들은 흔적 불순물로부터 색상을 얻습니다. 루비는 크롬에서 색상을 얻는 반면 사파이어는 철과 티타늄에서 색상을 얻습니다.
- 산업 응용 - 알루미나는 강도로 인해 사포에 대한 연마제로 사용됩니다. 또한 불활성 특성으로 인해 벽돌, 클레이웨어 및 플라스틱의 필러로 사용됩니다. 또한보다 경제적 인 옵션으로 다이아몬드를 대체합니다. 치약과 선 스크린의 성분이 될 수 있습니다.
결론
산화 알루미늄은 알루미나로도 알려져 있으며 화학적 공식은 Al2O3입니다. 그 구조는 2 개의 알루미늄 원자와 3 개의 산소 원자로 구성됩니다. 각각의 알루미늄 원자는 3 개의 전자를 잃어 +3 전하를 얻고, 각 산소 원자는 2 개의 전자를 얻어 -2 전하를 얻는다.
.Alumina는 Bayer의 과정을 통해 준비 할 수 있습니다. 이 과정에서 보크 사이트 (알루미늄 광석)는 가성 소다 (NaOH)로 가열됩니다. 이 과정에서 나트륨 알루미 네이트 (Naalo2)가 얻어지며, 물로 희석 될 때 알루미늄 수산화물 (Al (OH) 3)을 제공합니다. 수산화 알루미늄이 가열되면 산화 알루미늄 및 수증기가 얻어집니다.
Alumina는 녹고 끓는점이 높고 전기에 내성이 있으며 물에 불용성이 있습니다. 그것은 본질적으로 수륙 양용이며, 즉 산 및 염기와 반응합니다. 의료 산업, 전자 산업, 보석 산업, 보호 장비 제조 등에 사용됩니다.