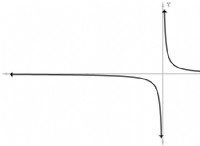
$$ \ delta t_b =k_b \ times m $$
여기서 î "TB는 끓는점의 변화 인 경우, KB는 용매의 비등점 상승 상수이며, M은 용액의 몰입니다.
우리는 î "tb =100.680 ° C -100.000 ° C =0.680 ° C이며, 용매는 물이고, 이는 kb =0.512 ° C/m의 비등점 상승을 갖는 물입니다.
이 값을 방정식으로 대체하면 다음을 얻습니다.
$$ 0.680 ° C =0.512 ° C/M \ Times M $$
M에 대한 해결, 우리는 다음을 얻습니다.
$$ M =1.33 M $$
이는 용액이 킬로그램 당 1.33 몰의 용질을 함유 함을 의미합니다.
용질의 몰 질량을 계산하기 위해 다음 방정식을 사용할 수 있습니다.
$$ molarity =\ frac {moles \ text {of solute}} {liters \ text {solution}} $$
우리는이 용액에 1.33 몰의 용질이 포함되어 있으며, 물의 밀도 (1 g/ml)를 사용하여 용액의 리터를 계산할 수 있습니다.
$$ liters \ text {solution} =\ frac {3.90 \ times 10^{2} g} {1 g/ml} =390 ml $$
이제 우리는 어금니 질량 공식을 사용할 수 있습니다.
$$ molarity =\ frac {1.33 \ text {mol}} {0.390 \ text {l}} $$
어금니는 다음과 같습니다.
$$ Molarity =3.41 $$
마지막으로, 우리는 다음 방정식을 사용하여 용질의 몰 질량을 계산합니다.
$$ molar \ text {mass} =\ frac {Grams \ text {of solute}} {moles \ text {solute}} $$
우리가 알고있는 가치를 대체하면 다음을 얻습니다.
$$ molar \ text {mass} =\ frac {64.3 g} {1.33 mol} $$
$$ molar \ text {mass} =48.3 \ text {g/mol} $$
따라서, 용질의 몰 질량은 48.3 g/mol이다.