1. 양성자 :양성자는 원자의 핵에서 발견되는 양으로 하전 된 입자이다. 핵은 대부분의 질량이 집중된 원자의 중심 코어입니다. 양성자는 중성자와 함께 핵의 중심에 위치합니다.
중성자 :중성자는 양성자와 함께 핵에서 발견되는 중성 입자 (전하 없음)입니다. 중성자는 원자의 질량에 기여하지만 화학적 특성에 직접적인 영향을 미치지 않습니다.
3. 전자 :전자는 특정 에너지 수준 또는 전자 쉘에서 핵 주위에 공전하는 음으로 하전 된 입자입니다. 전자는 에너지 수준에 따라 껍질로 배열되며 각 쉘은 핵과 다른 거리를 나타냅니다.
에이. 첫 번째 에너지 수준 (K-Shell) :핵에 가장 가까운 첫 번째 에너지 레벨에는 최대 두 개의 전자가 포함됩니다.
비. 두 번째 에너지 수준 (L-SHELL) :두 번째 에너지 레벨은 최대 8 개의 전자를 유지할 수 있습니다.
기음. 세 번째 에너지 수준 (M-Shell) :세 번째 에너지 수준은 최대 18 개의 전자를 수용 할 수 있습니다.
디. 더 높은 에너지 수준 :핵에서 더 나아가면서 더 높은 에너지 수준은 요소에 따라 특정 구성으로 더 많은 전자를 수용 할 수 있습니다.
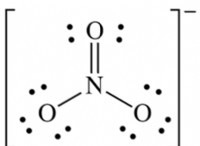
4. 궤도 :각 에너지 수준 내에서 전자는 궤도라고 불리는 특정 영역을 차지합니다. 궤도는 핵 주변에서 전자를 발견 할 수있는 가능한 위치를 나타냅니다. 다른 유형의 궤도에는 S, P, D 및 F 궤도가 포함되며 각각은 별개의 모양과 방향을 갖습니다.
요약하면, 양성자와 중성자는 원자의 중심의 핵에 함께 위치하며, 전자는 핵을 둘러싼 특정 에너지 수준 또는 껍질에서 발견된다. 이 하위 원자 입자의 배열 및 거동은 원소와 분자의 특성과 화학적 거동을 결정합니다.