H2O는 분자간 힘의 차이로 인해 H2SE보다 끓는점이 훨씬 높습니다. H2O 분자는 수소 결합에 의해 함께 유지되며, 이는 강한 분자간 힘이다. 수소 결합은 분자의 수소 원자가 산소 또는 질소와 같은 고도로 전기 음성 원자에 결합 될 때 발생합니다. 전기 음성 원자는 수소 원자의 전자 구름을 그 자체로 끌어 당겨 수소 원자에 부분 양전하를 만듭니다. 이 부분 양전하는 다른 전기 음성 원자에서 부분 음전하를 유치하여 수소 결합을 형성합니다.
반면에, H2SE 분자는 Van der Waals의 힘에 의해 함께 유지되며, 이는 분자간 힘이 훨씬 약합니다. 반 데르 발스 힘은 두 분자의 전자 구름이 순간적으로 겹쳐서 임시 쌍극자를 생성 할 때 발생합니다. 그런 다음이 쌍극자는 서로를 끌어 들여 반 데르 발스 힘을 형성합니다.
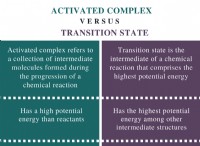
수소 결합은 반 데르 발스 힘보다 훨씬 강한 분자간 힘이기 때문에, H2O 분자는 H2SE 분자보다 훨씬 더 단단히 유지된다. 이것은 H2O 분자 사이의 분자간 힘을 깨고 끓이는 데 더 많은 에너지가 필요하다는 것을 의미합니다. 따라서, H2O의 끓는점은 H2SE의 끓는점보다 훨씬 높다.
수소 결합 외에도, H2O 및 H2SE의 끓는점의 차이는 또한 분자 질량의 차이에 기인 할 수있다. H2O는 분자 질량 18 g/mol을 가지며, H2SE는 80 g/mol의 분자 질량을 갖는다. 분자가 무겁을수록 분자 간 력을 깨고 끓여서 더 많은 에너지가 필요합니다. 따라서, 더 무거운 H2SE 분자는 가벼운 H2O 분자보다 더 높은 끓는점을 갖는다.