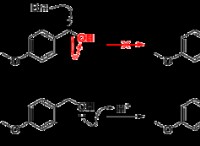
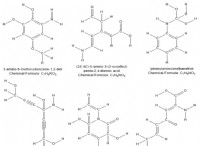
화합물과 요소 비교 :파괴
다음은 요소와 화합물이 어떻게 다른지에 대한 고장으로 구성 및 특성에 중점을 둡니다.
요소
* 정의 : 화학적 수단으로 간단한 물질로 분해 될 수없는 순수한 물질. 그들은 모든 문제의 빌딩 블록입니다.
* 예 : 금 (AU), 산소 (O), 탄소 (C), 수소 (H)
* 속성 : 요소는 용융점, 끓는점, 밀도, 반응성 및 전도도와 같은 독특하고 뚜렷한 특성을 갖습니다. 이들 특성은 원자에서 전자 및 양성자의 배열에 의해 결정된다.
화합물
* 정의 : 물질은 둘 이상의 다른 요소가 고정 비율로 화학적으로 결합 될 때 형성됩니다.
* 예 : 물 (H₂O), 이산화탄소 (Co₂), 염화나트륨 (NaCl)
* 속성 : 화합물은이를 구성하는 요소와 비교하여 완전히 다른 특성을 갖는다. 예를 들어, 나트륨은 반응성이 높은 금속이고 염소는 독성 가스입니다. 그러나 그들의 조합 인 클로라이드 나트륨 (테이블 소금)은 안정적이고 식용 물질입니다.
주요 차이점 :
* 구성 : 원소는 한 가지 유형의 원자로 만 구성되는 반면, 화합물은 화학적으로 결합 된 2 개 이상의 다른 유형의 원자로 구성됩니다.
* 형성 : 요소는 자연적으로 존재하는 반면 화합물은 화학 반응을 통해 형성됩니다.
* 분리 : 요소는 화학적 수단에 의해 단순한 물질로 분해 될 수 없지만 화합물은 화학 반응을 통해 구성 요소로 분리 될 수 있습니다.
* 속성 : 화합물은 구성된 요소와 다른 고유 한 특성을 가지고 있습니다.
예 :
* 물 (h>o) : 이 화합물은 2 개의 수소 원자와 하나의 산소 원자에 의해 형성된다. 그것은 실온에서 액체이며 투명하며 생명에 필수적입니다. 수소 나 산소는 이러한 특성을 개별적으로 가지고 있지 않습니다.
* 소금 (NaCl) : 고도로 반응성 금속 인 나트륨 (NA) 및 독성 가스 인 염소 (CL)는 결합하여 테이블 소금을 형성합니다.
요약 :
요소는 물질의 기본 빌딩 블록이지만, 화합물은 특정 비율로 요소를 결합하여 형성되어 개별 요소와 구별되는 고유 한 특성을 초래합니다. 요소와 화합물의 차이를 이해하는 것은 우리 주변 세계에 존재하는 방대한 자료를 이해하는 데 중요합니다.