산성 산화물 :빠른 개요
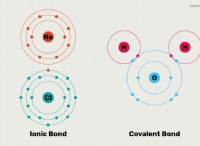
산성 산화물은 이진 화합물이다 다른 원소가 산소보다 전기 음성 인 산소와 적어도 하나의 다른 원소를 함유 . 그것들은 일반적으로 비금속 산화물입니다 물과 반응하여 산 를 형성한다 .
산성 산화물의 주요 특성 :
* 비금속 특성 : 대부분의 산성 산화물은 황, 인, 염소 및 탄소와 같은 비금속에 의해 형성됩니다.
* 물과의 반응 : 그들은 물과 반응하여 산을 형성합니다. 예를 들어, 황화 (SO₃)는 물과 반응하여 황산 (HASSOA)을 형성합니다.
* 염기와의 반응 : 그들은 염기와 물을 형성하기 위해 기초와 반응합니다. 예를 들어, 이산화탄소 (Co₂)는 수산화 나트륨 (NaOH)과 반응하여 탄산나트륨 (Na₂co₃) 및 물 (HATE)을 형성합니다.
* pH 7 미만 : 물에서 산성 산화물의 용액은 산성이며 7보다 적은 pH를 갖는다.
산성 산화물의 예 :
* 이산화탄소 (Co₂) : 물에서 카본 산 (H₂Co₃)을 형성합니다.
* 이산화황 (So₂) : 물에서 황산 (HASSOA)을 형성합니다.
* 삼산화 황 (So₃) : 물에서 황산 (H₂SOA)을 형성합니다.
* 이산화 질소 (No₂) : 물에서 질산 (Hno₃)을 형성합니다.
* 인 펜 옥사이드 (p₂o₅) : 물에서 인산 (H₃Po₄)을 형성합니다.
참고 : 일부 산화물은 반응 조건에 따라 산성 및 기본으로 작용할 수 있으며, 이들은 양서류 산화물이라고합니다. . 예를 들어, 산화 알루미늄 (알루미늄)은 강한 염기와 반응 할 때 및 강산과 반응 할 때 기본 산화물로서 산화 산화물로서 작용할 수있다.
산성 산화물의 적용 :
* 산의 산업 생산 : 산성 산화물은 다양한 산의 산업 생산에 사용됩니다.
* 비료 생산 : 인 펜 옥사이드에서 생산 된 인산은 비료의 핵심 성분입니다.
* 세제 생산 : 삼산화 황에서 생산 된 황산은 세제 생산에 사용됩니다.
* 식품 생산 : 이산화탄소는 탄산 음료 생산에 사용되며 베이킹의 누출 제로 사용됩니다.
산성 산화물을 이해하면 다양한 화학 반응과 다른 분야에서의 적용을 이해하는 데 도움이됩니다.