1. 염소 원자 (중성)
* bohr 모델 : BOHR 모델은 특정 에너지 수준 또는 "쉘"의 전자로 둘러싸인 중심 핵을 묘사합니다. 염소의 경우 원자 수는 17 개로 17 개의 양성자와 17 개의 전자가 있습니다.
* 핵 : 17 개의 양성자 및 18 또는 20 중성자 (동위 원소에 따라 다름)
* 전자 구성 : 첫 번째 쉘에 2 개의 전자, 두 번째 쉘에서 8, 세 번째 쉘에서는 7이 전자. 이 배열은 안정적인 구성을 제공합니다.
2. 염소 동위 원소
* 정의 : 동위 원소는 동일한 원소 (동일한 수의 양성자)의 원자이지만 다른 수의 중성자입니다.
* bohr 모델 : 염소 동위 원소의 BOHR 모델은 일반 염소 원자 (각각 17)와 동일한 수의 양성자 및 전자를 가질 것이다. 유일한 차이점은 핵의 중성자 수입니다.
* 일반적인 동위 원소 : 염소는 염소 -35 (18 중성자)와 염소 -37 (20 중성자)의 두 가지 주요 동위 원소를 가지고 있습니다.
3. 염소 이온
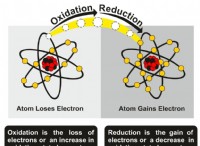
* 정의 : 이온은 전자를 얻거나 잃어버린 원자이며, 순 양성 또는 음전하를 초래합니다.
* bohr 모델 : 염소 이온의 BOHR 모델은 중성 원자와 비교하여 전자의 수에서 다를 것입니다.
* 염소 음이온 (Cl-) : 염소는 하나의 전자를 얻기 위해 안정적인 옥켓 구성을 달성합니다. 이것은 음전하를줍니다.
* 전자 구성 : 첫 번째 쉘에 2 개의 전자, 두 번째 쉘에서 8, 세 번째 쉘에서 8.
* 염소 양이온 (Cl+) : 염소는 양이온을 거의 형성하지는 않지만 가설 적으로 하나의 전자를 잃어 양전하를 제공합니다.
* 전자 구성 : 첫 번째 쉘에 2 개의 전자, 두 번째 쉘에서 8, 세 번째 쉘에서 6 개.
요약
* 동위 원소 : 동일한 수의 양성자와 전자, 그러나 다른 수의 중성자.
* 이온 : 같은 수의 양성자이지만 다른 수의 전자 (획득 또는 손실).
* 중성 원자 : 같은 수의 양성자와 전자가 있습니다.
시각적 표현
온라인 도구를 찾거나 자체 BOHR 모델을 그리서 이러한 차이점을 시각화 할 수 있습니다. 핵심은 각 원자 또는 이온을 정확하게 묘사하기 위해 양성자, 전자 및 중성자의 수를 기억하는 것입니다.