일반 규칙 :
* 자유 요소 : 원소 형태의 원자의 산화 수는 항상 0 입니다. .
* 그룹 17 (할로겐) : 할로겐은 보통 -1 의 산화 수를 갖는다 산소 또는보다 전기 음성 요소에 결합 된 경우를 제외하고.
* 그룹 16 (chalcogens) : 이들 요소는 일반적으로 산화 수가 -2 를 갖는다 산소 또는보다 전기 음성 요소에 결합 된 경우를 제외하고.
* 그룹 15 (Pnictogens) : 이들 요소는 일반적으로 산화 수의 -3 를 갖는다 , 그러나 양의 산화 수를 가질 수 있습니다.
* 수소 : 일반적으로 산화 수는 +1 입니다 , -1 인 금속 히드 라이드를 제외하고 .
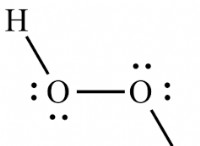
* 산소 : 일반적으로 산화 수는 -2 입니다 , 퍼 옥사이드 (-1)와 불소에 결합 된 경우 (양성).
예 :
* 염소 (CL) : NaCl (염화나트륨)에서 염소는 산화 수가 -1 입니다. . CLO2 (이산화 염소)에서, 산화 수는 +4 입니다. .
* 황 (s) : H2S (황화수소)에서 황은 산화 수가 -2 입니다. . SO3 (트라이 산화 황)에서, 산화 수는 +6 입니다. .
* 질소 (N) : NH3 (암모니아)에서 질소는 -3 의 산화 수 를가집니다. . HNO3 (질산)에서, 산화 수는 +5 입니다. .
산화 수 결정 :
1. 규칙을 알고 있습니다 : 공통 비금속에 대한 일반적인 규칙을 암기하십시오.
2. 전기 음성에 따라 산화 번호를 할당 : 결합에서 더 전기 음성 요소는 음의 산화 수가 할당됩니다.
3. 산화 수의 합 : 중성 분자에서 산화 수의 합은 0 입니다. . 다 원자 이온에서 산화 수의 합은 이온의 전하와 동일하다.
키 포인트 : 비금속은 다재다능하며 다양한 산화 상태와 화합물을 형성 할 수 있습니다. 따라서, 그들의 전기 음성과 산화 수 할당 규칙을 이해하는 것은 다른 화학 반응에서 그들의 행동을 예측하는 데 필수적이다.