1. 관련된 요소를보십시오 :
* 비금속 : 공유 화합물은 주로 둘 이상의 비금속 사이에 형성된다. 산소 (O), 질소 (N), 탄소 (C), 황 (S), 인 (P), 할로겐 (F, CL, BR, I) 및 수소 (H)와 같은 원소를 생각하십시오.
* 예외 : 비금속 (HCL, HAT, NH주)을 갖는 수소를 함유하는 화합물 및 금속성 (실리콘 및 붕소)을 함유하는 몇 가지 화합물과 같은 일부 예외가 존재한다.
2. 채권의 유형을 고려하십시오 :
* 공유 전자 : 공유 화합물은 원자가 안정적인 전자 구성을 달성하기 위해 전자를 공유 할 때 형성된다.
* 이온 없음 : 이온 성 화합물과 달리, 공유 화합물은 전자의 전달을 포함하여 하전 된 이온을 형성하지 않습니다.
3. 속성을 관찰하십시오 :
* 낮은 용융 및 끓는점 : 공유 화합물은 일반적으로 이온 성 화합물보다 용융점 및 비등점이 더 낮습니다.
* 비전도 : 그것들은 일반적으로 고체 및 액체 상태 모두에서 전기 도체가 열악합니다.
* 가변 물질 상태 : 공유 화합물은 실온에서 고체, 액체 또는 가스로 존재할 수 있습니다.
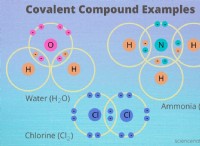
예 :
* 물 (h>o) : 2 개의 수소 원자는 산소 원자와 전자를 공유합니다.
* 이산화탄소 (Co₂) : 탄소는 두 개의 산소 원자와 전자를 공유합니다.
* 메탄 (ch₄) : 탄소는 4 개의 수소 원자와 전자를 공유합니다.
* 에탄올 (c₂h₅oh) : 탄소, 수소 및 산소 사이에 다중 공유 결합이 포함되어 있습니다.
주요 팁 :
* 일반적인 비금속을 암기하십시오 : 이것은 잠재적 인 공유 화합물을 신속하게 식별하는 데 도움이됩니다.
* 이름으로 접두사를 찾으십시오. 공유 화합물은 종종 "mono", "di", "tri"등과 같은 접두사를 사용하여 분자의 각 요소의 수를 나타냅니다.
* 예외를 기억하십시오 : 대부분의 공유 화합물은 위의 패턴에 맞지만 모든 규칙에 예외가 있음을 알아야합니다.
더 많은 예를 원하거나 분류하려는 특정 화합물이 있으면 알려주십시오!