다음은 고장입니다.
개념 이해
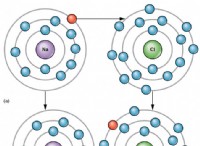
* 산 물에 용해 될 때 수소 이온 (H+)을 방출하여 용액을 산성으로 만듭니다.
* 베이스 수산화물 이온 (OH-)을 물에 용해시켜 용액을 기본으로 만듭니다.
* 소금 산 및 염기의 반응에 의해 형성된 이온 성 화합물이다. 그것들은 특정 산과 형성에 관련된 염기에 따라 산성, 기본 또는 중성 일 수 있습니다.
소금 중화가 작동하는 방법
1. 소금 추가 : 산성 또는 기본 용액에 적합한 소금을 첨가하면 소금이 이온에 분리됩니다.
2. 이온 상호 작용 : 이들 이온은 기본 용액에서 산성 용액 또는 수산화물 이온 (OH-)에서 수소 이온 (H+)과 상호 작용한다.
3. 중화 : 소금 이온과 과량의 H+ 또는 오하이온 사이의 상호 작용은 농도의 감소를 초래하여 용액을 중성 pH (약 7)에 더 가깝게 만듭니다.
예 :
* 중탄산 나트륨 (NAHCO3) 기본 소금입니다. 산성 용액에 첨가되면 H+ 이온과 반응하여 탄산 (H2CO3) 및 물을 형성합니다. 그런 다음 탄산은 이산화탄소와 물로 분해되어 산을 효과적으로 중화시킨다.
* 나트륨 아세테이트 (CH3coona) 강한 염기 (NaOH) 및 약산 (아세트산)으로부터 형성된 염이다. 산성 용액에 첨가되면 H+ 이온과 반응하여 아세트산 및 물을 형성합니다. 아세트산은 완충제로서 작용하여보다 안정적인 pH를 유지하는 데 도움이된다.
중요한 메모 :
* 염 중화의 효과는 사용 된 특정 염과 산 또는 염기의 농도에 따라 다릅니다.
* 모든 소금이 중화에 적합한 것은 아닙니다. 일부 염은 용액을보다 산성이거나 기본적으로 만들 수 있습니다.
* 소금 중화는 복잡한 과정이며, 관련된 특정 반응은 소금 및 용액에 따라 다를 수 있습니다.
응용 프로그램 :
* 화학 공정 : 염 중화는 다양한 화학 공정에서 사용되어 용액의 pH를 조정하고 원치 않는 반응을 방지합니다.
* 폐수 처리 : 소금은 폐수 처리에 사용되어 산성 또는 기본 폐수가 배출되기 전에 중화됩니다.
* 식품 산업 : 소금 중화는 식품의 pH를 조정하고 맛을 개선하며 저장 수명을 보존하는 데 사용됩니다.
소금 중화는 화학의 기본 개념이며 많은 분야에서 중요한 역할을합니다. SALT가 산성 및 기본 용액과 상호 작용하는 방법을 이해하는 것은 pH를 제어하고 안전하고 효과적인 화학 공정을 보장하는 데 필수적입니다.