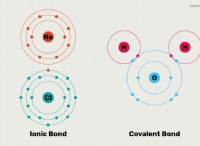
* 이온은 항상 가용성입니다. 이온은 하전 입자이며, 용해 된 이온으로서 용액에 존재한다. 그것들은 본질적으로 용매 분자로 둘러싸여 있으며 고체 침전물로 존재하지 않는다는 의미에서 용해됩니다.
* 불파도는 화합물을 말합니다 : 불파도의 개념은 개별 이온이 아닌 * 이온 성 화합물 * (Salts)에 적용됩니다. 화합물은 주어진 용매, 종종 물에 쉽게 용해되지 않을 때 "불용성"으로 간주됩니다.
무엇이 화합물을 불용성 하는가?
* 이온 결합 강도 : 화합물에서 양성 이온과 음의 이온 사이의 정전기 인력의 강도는 그것이 얼마나 쉽게 용해 될지를 결정합니다. 더 강한 결합은 용매 분자가 이온을 차별화하기가 더 어려워집니다.
* 격자 에너지 : 이온 성 화합물의 결정 격자를 분해하는 데 필요한 에너지는 용해도의 요인입니다. 높은 격자 에너지는 낮은 용해도에 해당합니다.
* 수화 에너지 : 이온 성 화합물이 용해 될 때, 이온은 용매 분자 (물과 같은)로 둘러싸여있다. 이 과정에서 방출 된 에너지를 수화 에너지라고합니다. 수화 에너지가 격자 에너지보다 낮 으면 화합물이 용해되지 않습니다.
예 :
* 염화은 (Agcl) : 이것은 불용성 화합물의 전형적인 예입니다. 은과 염화물 이온과 상대적으로 낮은 수화 에너지 사이의 강한 인력은 물에 크게 녹지 않는 화합물을 초래합니다.
* 탄산 칼슘 (CACO3) : 마찬가지로, 껍질과 석회암에서 발견되는 탄산 칼슘도 불용성으로 간주됩니다.
중요한 참고 : 불용성 화합물조차도 용액에 용해 된 매우 적은 양의 이온이 있습니다. 이것은 용해도 생성물 상수 (KSP)로 알려져 있으며 화합물이 용해되는 정도의 척도입니다.
요약 : "불용성"화합물이 있지만 "불용성 이온"이라는 용어는 정확하지 않습니다. 이온은 항상 가용성이며, 다양한 양의 용해도를 나타내는 화합물입니다.